服务热线
177-5061-9273

紫罗兰酮-又称香堇酮,属于玫瑰酮类化合物家族的一分子,是从类胡萝卜素降解得来。有α,β,γ三种异构物,但只有α、β才是天然的,多半同时存在于紫罗兰、桂花、鸢尾草精油中,γ为人工合成物质。紫罗兰酮是单独闻并不特别香的成分,但是只要和其他芳香分子混合后,优雅的紫罗兰花香就会迸发出来。
| 中文名称 | α-紫罗兰酮 | β-紫罗兰酮 | 鸢尾草酮,又称甲基-紫罗兰酮 |
| 英文名称 | α-Ionone | β-Ionone | Irone |
| 精油来源 | 桂花(β为主)、鸢尾草、紫罗兰、红花缅栀、穗甘松、云木香 | ||
| 气味描述 | 甜腻莓果香、近似覆盆子果酱,有很强大的气味冲击性 | 有点像桂花、雪松那样幽微、隐喻的气味 | 紫罗兰、鸢尾花的干燥气味,带有一点甜 |
| 芳疗功效 | 1.穿透性强,可以游走在免疫细胞附近,直接抑制癌细胞扩散、抗癌效果强大但机制不明,以β-紫罗兰酮为翘楚;2.温和的化痰、去除拥塞感,适合年幼体虚者在呼吸不顺、感冒时使用 | ||
| 心灵功效 | 强大的保护与修复力,化解心中烦闷 | 治愈人的抑郁与忧伤 | 使人心情舒畅,精神爽朗 |
紫罗兰酮是一种由13个碳组成的酮类化合物,具有一个单环萜类骨架。ionone这个术语来源于“iona”(希腊语中紫罗兰的意思),指的是紫罗兰的气味,而“酮”则与它的结构有关。
在自然界中存在多种异构体,包括α-紫罗兰酮、β-紫罗兰酮等。紫罗兰酮是植物的次生代谢产物,与甲戊酸有共同的前体。它们广泛存在于含有β-胡萝卜素的水果和蔬菜中,并在植物精油中被发现,例如矮牵牛(Petunia hybrida)、波罗尼花(Boronia megastigma Nees)和尤其是香堇菜(Viola odorata)的精油中。它存在于牛乳中,是牛在食用苜蓿牧草后被动转移所至。
α-紫罗兰酮和β-紫罗兰酮分别被2,6,6-三甲基-2-环己烯-1-基和2,6,6-三甲基-1-环己烯-1-基取代的3-丁烯-2-酮。紫罗兰酮立体异构体α-紫罗兰酮和β-紫罗兰酮是淡黄色到黄色的液体,具有木香花香。然而,前者有额外的蜂蜜气味方面。α-紫罗兰酮和β-紫罗兰酮具有相似的理化性质。它们均可溶于大多数固定油、醇和丙二醇,但不溶于或极微溶于甘油/水。
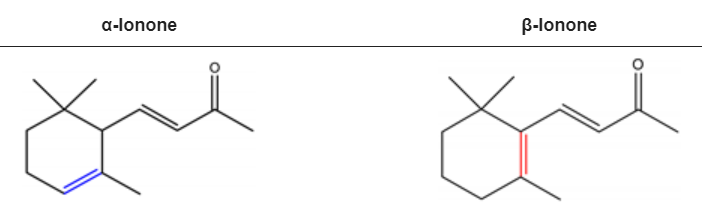
α-紫罗兰酮和β-紫罗兰酮的化学结构
α-紫罗兰酮和β-紫罗兰酮都被广泛用于各种行业的芳香成分,包括化妆品(如洗发水、肥皂)和非化妆品(如家用洗涤剂和清洁剂)产品。香精和提取物制造商协会(FEMA)宣布,当用作调味剂时,这两种紫罗兰酮通常被认为是安全的(GRAS)。美国食品药品监督管理局也批准了它们作为调味剂的使用。
紫罗兰酮的维基百科
紫罗兰酮(Ionone),又称香堇酮,是一种萜类物质,根据双键位置不同有三种异构体。香堇酮的词源是希腊语Ίον(Íon),意思是香堇菜。中文常将香堇菜误译为紫罗兰,两者实为不同物种。
紫罗兰酮属于玫瑰酮,存在于包括玫瑰精油的多种花精油中。β-紫罗兰酮是玫瑰香气的主要贡献物,虽然其在精油中含量相对较低。紫罗兰酮是一个重要的香料化学品,用于香水,香料和调味料。[1]紫罗兰酮在生物中来源于类胡萝卜素的降解。
胡萝卜素包括α-胡萝卜素,β-胡萝卜素,γ-胡萝卜素,叶黄素和β-隐黄质,都含有β-紫罗兰酮结构,具有维生素A的活性,它们在动物体内可转化成视黄醇。无β-紫罗兰酮结构的类胡萝卜素则不能被转换为视黄醇,没有维生素A活性。
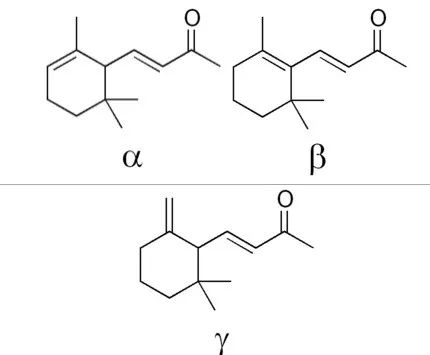
IUPAC名:α: (3E)-4-(2,6,6-Trimethylcyclohex-2-en-1-yl)but-3-en-2-one
β: (3E)-4-(2,6,6-Trimethylcyclohex-1-en-1-yl)but-3-en-2-one
γ: (3E)-4-(2,2-Dimethyl-6-methylenecyclohexyl)but-3-en-2-one
别名:Cyclocitrylideneacetone, irisone, jonon
CAS号:79-76-5 ;α: 127-41-3;β: 79-77-6;γ: 79-76-5
化学式:C13H20O
分子量:192.30 g/mol
密度:α: 0.933 g/cm3;β: 0.945 g/cm3
熔点:β: −49 °C
沸点:β: 126–128 °C at 12 mmHg
紫罗兰酮的化学合成
从植物精油提取的方法得到的量微且昂贵,紫罗兰酮主要通过化学合成。
柠檬醛和丙酮在氧化钙催化下缩合得假性紫罗兰酮(pseudoionone):[2][3]
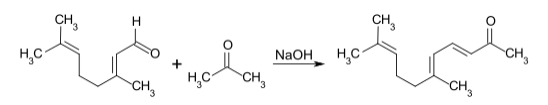
机理如下,是一个典型的羟醛缩合反应:
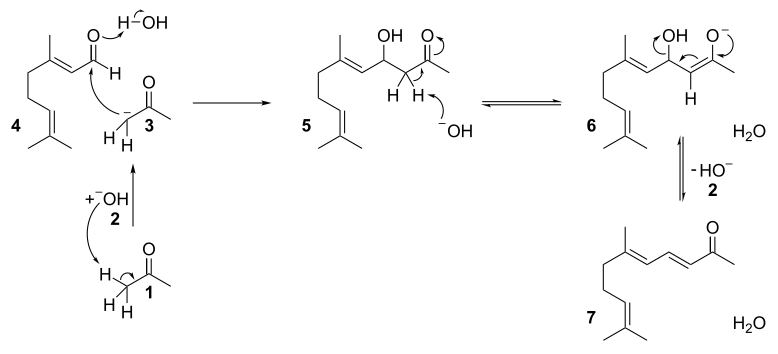
再由酸催化关环,发生碳正离子重排,得香堇酮的各种异构体。机理如下:
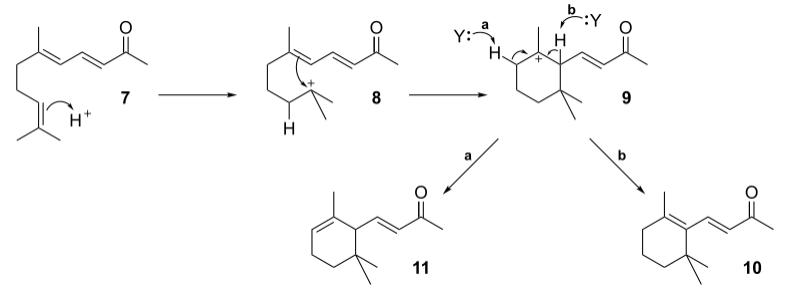
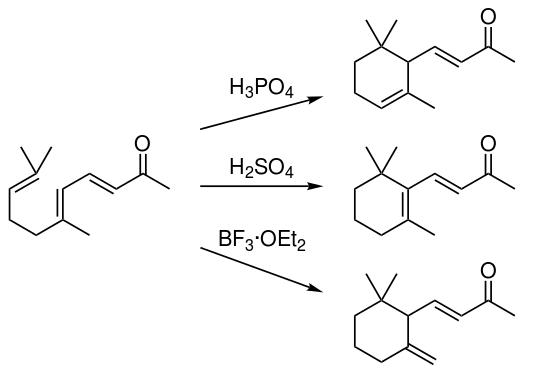
磷酸催化主要得α-异构体,硫酸催化主要得β-异构体,三氟化硼催化主要得γ-异构体。
空气中微量香堇酮就能被嗅觉捕获。α-香堇酮的阈值为3ppb(3×10−7mg/L),β-香堇酮位0.12ppb、(R)-γ-香堇酮为11ppb、(S)-γ-香堇酮为0.07ppb。[4]
紫罗兰酮的内源性合成
β-胡萝卜素氧合酶1(BCO1)
类胡萝卜素是水果和蔬菜中天然存在的化合物。它们是一类具有长共轭双键链结构的异戊二烯类化合物。在人体中,天然发现的主要类胡萝卜素是α-胡萝卜素、β-胡萝卜素、β-隐黄质、番茄红素和叶黄素。β-胡萝卜素在中央15,15 '双键处的氧化裂解产生两个全反式视黄醛对映异构体。然后,全反式视黄醛分别被氧化为全反式视黄酸或还原为全反式视黄醇(维生素A)。这一过程由胞浆酶β-胡萝卜素氧合酶1 (BCO1)完成,也被鉴定为β-胡萝卜素-15,15 ' -单氧合酶1 (BCMO1)。综上所述,类胡萝卜素要转化为维生素A,必须至少含有一个非取代的β-紫罗兰酮环,因此BCO1只能促进β-隐黄质、α-胡萝卜素和β-胡萝卜素的裂解。
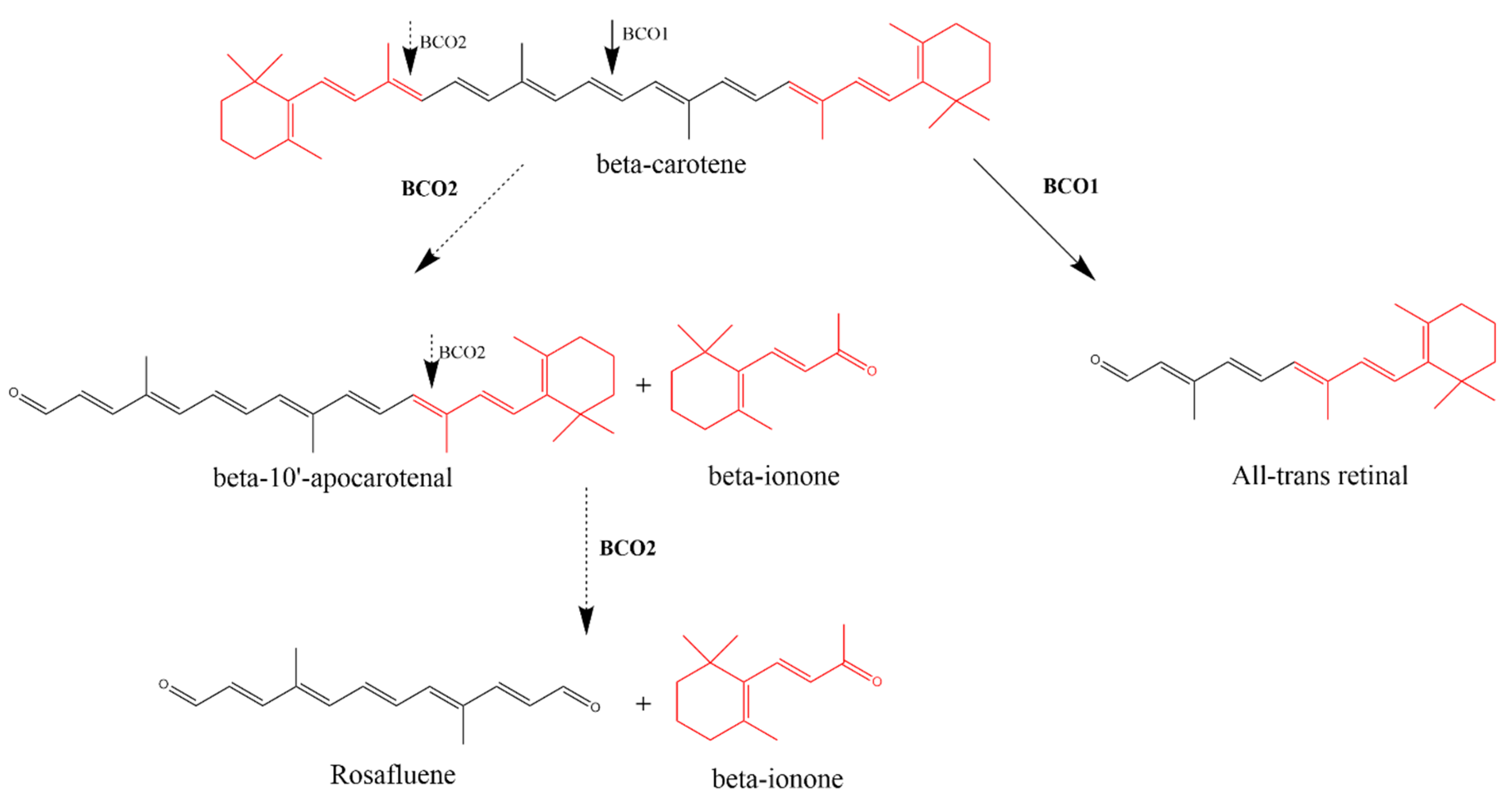
β-胡萝卜素氧合酶1 (BCO1)和β-胡萝卜素氧合酶2 (BCO2)对β-胡萝卜素的酶解作用。BCO1催化β-胡萝卜素在15,15 '双键的中心裂解,形成两个全反式视网醛对映异构体分子。β-胡萝卜素9,10双键的不对称裂解在BCO2的催化下产生了β-紫罗兰酮和β-10 ' -阿朴胡萝卜素醛(apocarotenal)。在9 ',10 '双键上的另一次裂解产生了另外的β-紫罗兰酮部分和蔷薇烯。
β-胡萝卜素氧合酶2 (BCO2)介导合成
德国弗莱堡大学的Vogt和von Lintig首次描述了紫罗兰酮的内源性合成,这种合成是通过酶介导的β-胡萝卜素的不对称裂解实现的。然而,美国凯斯西储大学的von Lintig对这种酶进行了进一步的研究。β-紫罗兰酮和β-apo-10 ' -胡萝卜素是β-胡萝卜素不对称裂解的产物。这种在9 ',10 '双键的裂解是由β-胡萝卜素氧合酶2 (BCO2)促进的,也被称为β-胡萝卜素-9 ',10 ' -双氧合酶2 (BCDO2)。另一个在9 ',10 '双键处的裂解产生额外的β-紫罗兰酮部分和蔷薇烯,蔷薇烯是一种自然存在于玫瑰中的化合物。BCO2和BCO2酶之间的差异并不局限于它们的拆分机制。BCO2可以不对称地拆分含有羟基化紫罗兰酮和非环类胡萝卜素(包括非维生素原A类胡萝卜素)的类胡萝卜素,如番茄红素和叶黄素,因此具有更广泛的底物特异性。此外,BCO2定位于线粒体内膜,而BCO1是胞质蛋白。BCO1和BCO2之间的这些差异表明了BCO2独特的生理作用。
β-胡萝卜素的中心裂解(通过BCO1)是类视黄醇(retinoid)生成的主要途径。同时,β-胡萝卜素的不对称裂解(通过BCO2)是类视黄醇(retinoid)生成的补充途径。后来有报道称BCO1基因敲除的小鼠重组BCO2后,具有维生素A缺乏症。此外,前列腺和子宫内膜结缔组织、内分泌胰腺、心脏和骨骼肌中只表达BCO2,不表达BCO1。值得注意的是,其中一些组织对维生素A缺乏并不敏感,因此BCO2被认为是独立于维生素A合成发挥生理作用的;这表明β-紫罗兰酮(BCO2的产物之一)可能参与了其他潜在的生物功能。BCO2可能对肝脂肪变性起到一定的预防作用。BCO2缺乏/突变导致各种动物脂肪组织和小鼠模型线粒体中类胡萝卜素的积累。类胡萝卜素反过来又会引起氧化应激,从而导致细胞凋亡。因此,BCO2可以保护细胞免受类胡萝卜素诱导的氧化应激带来的凋亡。β-紫罗兰酮水平与BCO2突变之间的关系尚未被研究。BCO2的突变或缺失可能导致β-紫罗兰酮水平的降低,并可能导致上述疾病的发病机制。此外,β-紫罗兰酮内源性合成的发现表明,β-紫罗兰酮可能具有尚未揭示的生理作用。统计学数据表明,大量摄入含有挥发性异戊二烯类物质的水果和蔬菜,可以降低患癌症的风险。目前的研究主要集中在BCO2和β-紫罗兰酮产生的原胡萝卜素(apocarotenoids)的生物学作用,而对β-紫罗兰酮的研究较少。
由蒎烯合成紫罗兰酮的可能性
松节油的主要成分是蒎烯。从松树油脂中提取的松节油被广泛应用于医药和葡萄酒中作为防腐剂和增味剂。人们注意到,食用松节油会使尿液的气味带有紫罗兰香。据传,埃及艳后克利奥帕特拉曾用松节油来达到这个目的。然而,将松节油与尿液混合并不能使尿液散发出紫罗兰般的气味。人们认为紫罗兰酮是产生紫罗兰气味的化合物。因此,松节油中最常见的化合物蒎烯应该转化为紫罗兰酮,然后紫罗兰酮必须从肾脏排出,以产生尿液中的紫罗兰气味。肝酶(细胞色素P450)可能参与了蒎烯向紫罗兰酮的转化。
Al-Tel和他的同事提出了α和β-蒎烯转化为α和β-ionone的可能代谢途径(下图)。首先,CYP酶会氧化α和β-蒎烯生成中间产物(1)和(a)。β-蒎烯(a)生成的中间体经过自由基重排生成中间体(b)。β-蒎烯(a)生成的中间体(b)从CYP中得到一个氢自由基生成中间体(c)。
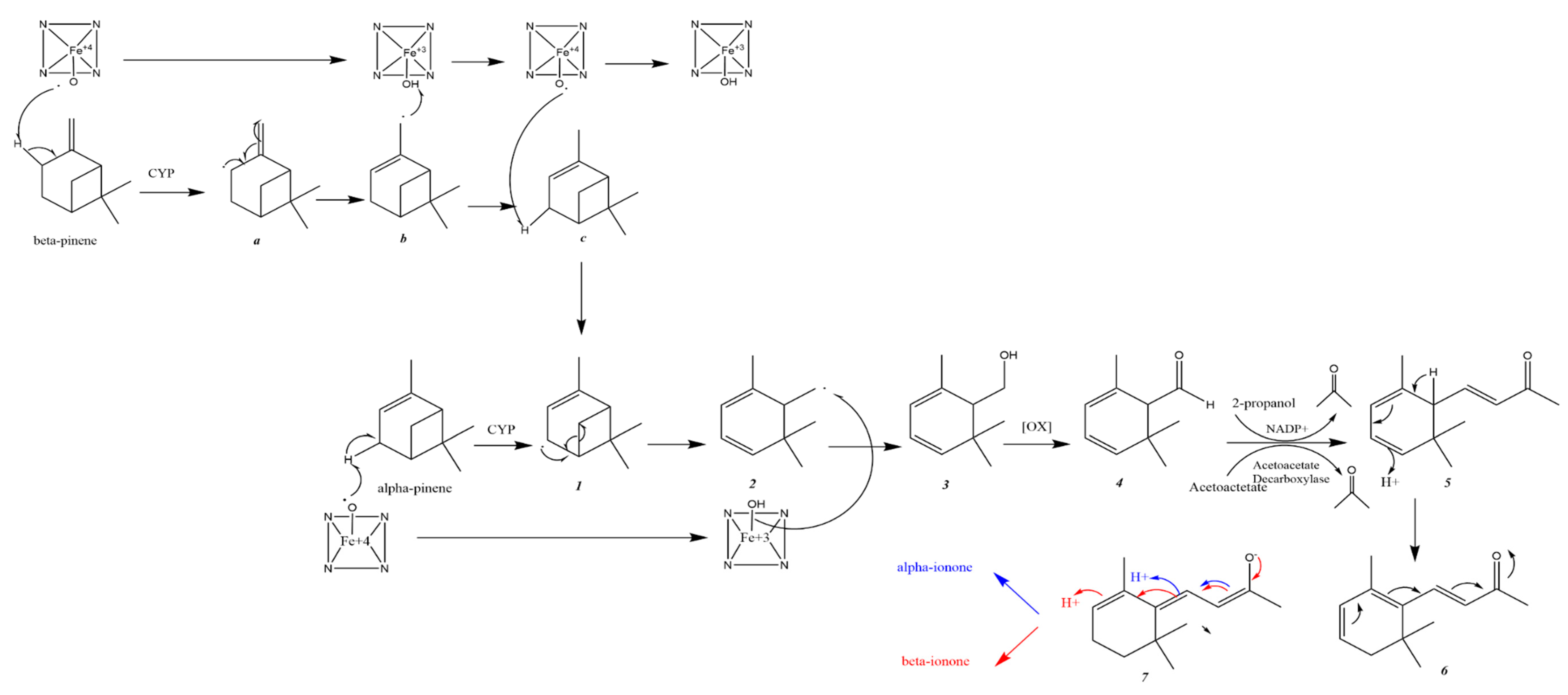
然后CYP从中间体(c)中提取氢自由基。至此,可以假设这两条途径通过中间体1的形成而相遇。随后自由基重排和环丁基环的裂解应该产生中间体2。后者氧化成醇3,再氧化成醛4。中间体4与丙酮发生克脑文盖尔缩合反应(Knoevenagel,指含有活泼亚甲基的化合物与醛或酮在弱碱催化下,发生失水缩合生成α,β-不饱和羰基化合物及其类似物)生成5。中间体5的sigma重排会生成中间体6。后者可以重新排列形成中间产物7,中间产物7又可以重新排列形成α-或β-紫罗兰酮。在这一推测的蒎烯向紫罗兰酮的代谢转化中,丙酮是一个关键的角色。它可以在生物体内通过乙酰乙酸脱羧或2-丙醇脱氢生成。前者是哺乳动物中丙酮的主要来源。所提出的催化反应是由计算的物理化学性质支持的。α-和β-紫罗兰酮的亲水性高于α-和β-蒎烯,表明蒎烯转化为紫罗兰酮有利于肾脏排泄。通过CYP亚型预测的蒎烯代谢位点为:1A2、3A4、2C19和2D6。
嗅觉受体
嗅觉受体(OR)是检测挥发性物质的G蛋白偶联受体。在嗅觉神经元中,OR与Golf(类似于Gαs的G蛋白)结合后激活腺苷酸环化酶并产生cAMP,从而导致细胞内钙离子的增加。1992年,Parmentier和他的同事在哺乳动物生殖细胞中发现了第一个OR基因转录本。进一步的研究表明,OR的表达并不局限于嗅上皮,但它们在迄今研究的所有人体组织中都有表达,如结肠、肺、卵巢、肝脏、肾脏、淋巴结、心脏、血液、睾丸、骨骼肌、皮肤、脂肪、肾上腺、大脑、乳房、前列腺和甲状腺。已经鉴定出40多种不同的OR,它们被发现在多于45种不同的人体组织中表达。OR的这种异位表达表明OR的功能不仅仅是气味的检测和辨别。有研究报道了异位表达OR的各种功能,如调节肠嗜铬细胞的血清素释放、癌细胞增殖、胞质分裂、血压、肾脏的酶分泌和精子的趋化。
几项研究表明,紫罗兰酮与OR51E2结合。OR51E2本质上是属于OR家族51和E亚家族的紫罗兰酮受体,它的成员2在哪里?OR51E2不仅是mRNA水平上表达最多的ORs之一;它存在于许多组织中。OR51E2在前列腺组织(3-∞FPKM)中含量最高,而在肝脏(0-0.01 FPKM)、大脑(0.01-0.1 FPKM)、睾丸(0.1-1 FPKM)和结肠(1-3 FPKM)中含量较低。
OR51E2在前列腺癌中表达增强。因此,它也被鉴定为前列腺特异性G蛋白偶联受体(PSGR),并被认为是前列腺肿瘤的标记物。然而,Cao等人报道,PSGR在前列腺上皮内瘤变中表达较高,但随着疾病进展为前列腺癌而降低。在前列腺癌患者中,发现低PSGR表达与较差的总生存期相关。OR51E2在人类黑色素瘤细胞中的数量要高于黑色素细胞。此外,最近的另一项研究表明OR51E2是人类成人和胎儿视网膜色素上皮中表达最多的OR转录本。有趣的是,OR51E2不仅存在于质膜中,还存在于良性和恶性前列腺上皮细胞、视网膜色素上皮细胞和黑色素细胞的胞浆中;特别是在黑素细胞的早期核内体抗原1中。
紫罗兰酮的香气与药理活性
β-紫罗兰酮具有多种药理作用,包括抗癌、化学预防、促癌、促黑、抗炎和抗菌活性。几种机制和细胞内信号级联已被报道解释这些效应。β紫罗酮激活OR51E2和调节细胞周期调控蛋白的活动或表现,促进细胞凋亡(pro-apoptotic)和抗凋亡蛋白,β-还原酶和促炎介质。
1、激活OR51E2-调控效果
研究表明β-紫罗兰酮通过激活OR51E2抑制前列腺癌细胞增殖并诱导其侵袭,而β-紫罗兰酮介导的OR51E2激活抑制黑素细胞增殖和迁移并诱导黑素生成。令人惊讶的是,β-紫罗兰酮介导的OR51E2激活增加视网膜色素细胞的增殖和转移,激活p44/42和蛋白激酶B (AKT)蛋白。
β-紫罗兰酮激活OR51E2导致激酶活性的调节和细胞内钙离子的增加(图1)。Neuhaus团队发现,β-紫罗兰酮激活OR51E2(而不是雄激素受体(AR))导致前列腺癌原发上皮细胞和前列腺癌细胞株细胞内钙离子浓度的增加(LNCaP)。进一步的实验表明,β-i紫罗兰酮通过磷酸化p38和应激活化蛋白激酶/Jun氨基末端激酶(SAPK/JNK)发挥抗增殖作用,它们是丝裂原活化蛋白激酶(MAPK)家族的成员。另一项研究发现β-紫罗兰酮通过调节MAPK通路抑制乳腺癌细胞的增殖。
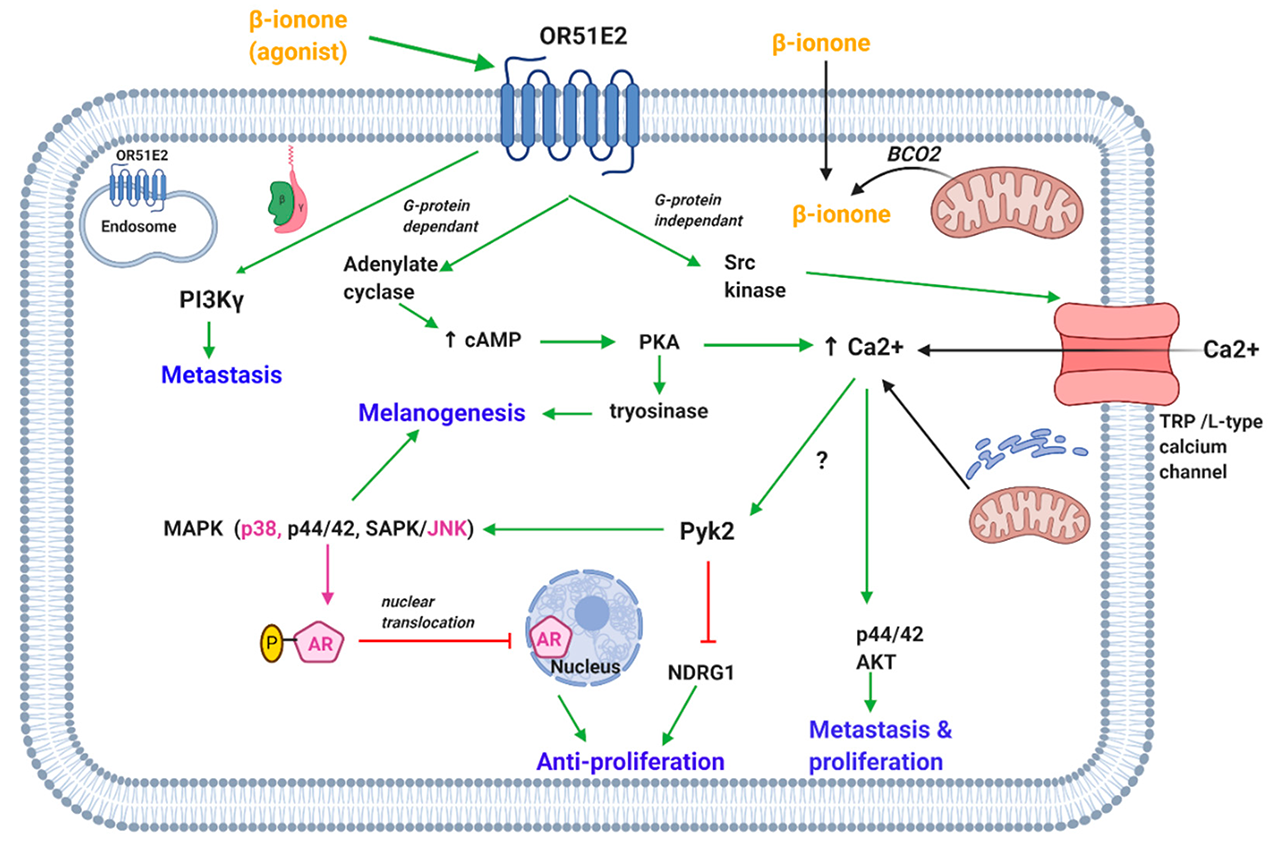
图1. β-紫罗兰酮介导的膜和胞质OR51E2受体的激活导致钙离子的增加和调节调节细胞增殖、转移和黑素生成的各种激酶的作用。(OR51E2,嗅觉受体51E2;BCO2, β-胡萝卜素氧合酶2;cAMP,环磷酸腺苷;PKA,蛋白激酶A;TRP钙通道,瞬时受体电位钙通道;Pyk2,富含脯氨酸的酪氨酸激酶2;MAPK,丝裂原活化蛋白激酶;SAPK/JNK,应激活化蛋白激酶/Jun氨基末端激酶;NDRG1, N-myc下游调控基因1;基于“增大化现实”技术,雄激素受体;AKT,蛋白激酶B;PI3Kɣ,磷酸肌醇3-激酶gamma)。[5]
Wiese等人表明,富含脯氨酸的酪氨酸激酶2 (Pyk2)在OR51E2激活后启动的信号级联中发挥关键作用(图1)。β-紫罗兰酮通过OR51E2)激活前列腺癌细胞中的Pyk2,可能是通过细胞内钙离子浓度的增加介导的。Pyk2增加p38 MAPK的磷酸化和N-myc下游调控基因1 (NDRG1)的去磷酸化。后者和Pyk2被认为负责β-紫罗兰酮介导的前列腺癌细胞的抗增殖作用。此外,本研究发现β-紫罗兰酮激活OR51E2可调控前列腺癌细胞信号转导和离子转运等过程中的各种蛋白。
Jones等人支持β-紫罗兰酮的抗增殖作用与AR无关的观点。然而,Xie等人最近的一项研究表明AR的存在是β-紫罗兰酮激活OR51E2所必需的。OR51E2刺激β-紫罗兰酮诱导的前列腺癌细胞株(LNCaP, C4-2和DU145)发生钙内流。然而,它仅抑制LNCaP和C4-2细胞的前列腺癌增殖,而这两种细胞在DU145细胞中不表达AR,值得注意的是,β-紫罗兰酮诱导的OR51E2的激活通过p38和jnk介导的AR磷酸化抑制了AR核转位(图1)。AR转位的抑制导致了AR转位激活的减少,从而阻碍了前列腺癌细胞的生长。这进一步得到了体内研究的支持,该研究表明β-紫罗兰酮抑制小鼠肿瘤生长,并引起AR、p38和JNK磷酸化的增加。
然而,Sanz报道β-紫罗兰酮通过激活OR51E2刺激介导的磷脂酰肌醇-4,5-二磷酸3-激酶-ɣ(PI3Kɣ)诱导前列腺癌(LNCaP)细胞侵袭(图1)。G蛋白的βɣ亚基激活PI3Kɣ。Cao等的一项研究表明,β-紫罗兰酮介导的OR51E2的激活抑制了C4-2细胞的增殖,但促进了它们的侵袭,这与LNCaP细胞的报道数据一致。值得注意的是,β-紫罗兰酮对前列腺肿瘤小鼠也能诱导细胞转移。另一方面,另一项研究发现β-紫罗兰酮联合索拉非尼(一种多激酶抑制剂)对人肝癌细胞的转移具有协同抑制作用。这是通过β-紫罗兰酮诱导组织抑制剂基质金属蛋白酶-1和-2表达上调来介导的,这是一种被广泛接受的转移抑制方法。
研究表明β-紫罗兰酮还通过激活OR51E2抑制黑素细胞的增殖。然而,β-紫罗兰酮通过诱导凋亡降低了lpa诱导的迁移,并延缓了垂直生长期(vertical-growth phase, VGP)黑色素瘤细胞的生长。β-紫罗兰酮则增加了黑素细胞的黑色素水平和两树突以上细胞的百分比。β-紫罗兰酮激活OR51E2介导黑素生成,激活腺苷酸环化酶,从而增加cAMP和蛋白激酶A (PKA)的激活。PKA可能负责上调黑素生成酶酪氨酸酶(图1)。此外,活化的MAPK (p44/42和p38)也可能是黑素生成的调节因子。结果表明,外部信号是由细胞膜上的OR51E2而不是细胞质内的OR51E2接收的。在此基础上,假定OR51E2通过β-紫罗兰酮对黑素细胞的重复刺激被插入细胞膜。
为此,研究探讨了OR51E2刺激下前列腺癌细胞钙离子增加的机制。瞬时受体电位香草样6 (transient receptor potential vanilloid type 6, TRPV6)通道在β-紫罗兰酮介导的OR51E2激活下游被激活。Src激酶在β-紫罗兰酮介导的钙内流中起关键作用;OR51E2直接激活Src激酶而不依赖于G蛋白的激活(图1)。
β-紫罗兰酮也可引起黑色素细胞和转移性和VGP培养细胞内钙浓度的增加,在前列腺肿瘤细胞中有报道。这一过程也通过激活表面OR51E2介导。来自细胞外空间和细胞内储存的钙是钙水平升高的原因,然而,发现前者是主要的显著贡献者(图1)。细胞外钙通过瞬时受体电位通道特别是TRPM注入,而不是前列腺癌细胞中报道的TRPV。
另一项研究表明β-紫罗兰酮诱导视网膜色素上皮细胞内钙离子的增加;钙起源于细胞外空间。钙的增加是通过激活cAMP通路介导的。虽然没有发现钙通道,但推测与之有关的是l型钙通道或TRP通道(如前列腺和黑色素细胞)。
看来,通过饮食和香味提供的外源性β-紫罗兰酮可能会激活质膜中的OR51E2。然而,有人提出,线粒体内BCO2内源性产生的β-紫罗兰酮也可能激活细胞内OR51E2。上述细胞中已经出现OR51E2的胞内定位。根据β-紫罗兰酮的疏水特性,它可以穿越细胞膜,因此,这似乎表明外源性、内源性β-紫罗兰酮均可能激活质膜,或胞质存在的OR51E2。
2、细胞周期调节蛋白介导的作用
β紫罗酮可以抑制乳腺癌细胞增殖,前列腺癌,人类结肠癌,人类胃腺癌,小鼠黑色素瘤B16细胞,人类白血病和结肠腺癌细胞株和体内乳腺癌腺,通过诱导细胞周期阻滞。
β-紫罗兰酮已被证明可通过使乳腺癌细胞系的细胞周期停滞在G1/G0期、人类结肠癌和前列腺癌细胞系(DU145、PC-3细胞)的G1期[以及人类胃癌和乳腺癌细胞系的G1/G0和G2/M期来抑制细胞增殖。
细胞增殖受细胞周期的调节。细胞周期蛋白、细胞周期蛋白依赖性激酶(CDK)和CDK抑制剂(CdkI)在调节细胞周期方面起着关键作用。细胞周期停滞是由细胞周期蛋白D1、细胞周期蛋白E、细胞周期蛋白B1、细胞周期蛋白A、Cdk2、Cdk4的减少解释的(图2)。Cdk对参与细胞周期进展的蛋白质进行磷酸化。Cdk只有在与细胞周期蛋白复合形成Cdk-细胞周期蛋白复合体时才会被激活。Cdk4-环蛋白D、Cdk2-环蛋白E、Cdk2-环蛋白A、Cdk1-环蛋白A和Cdk1-环蛋白B分别调节早期G1期、晚期G1期、S期的进展、G2/进入M期和M期的进展(图2)。
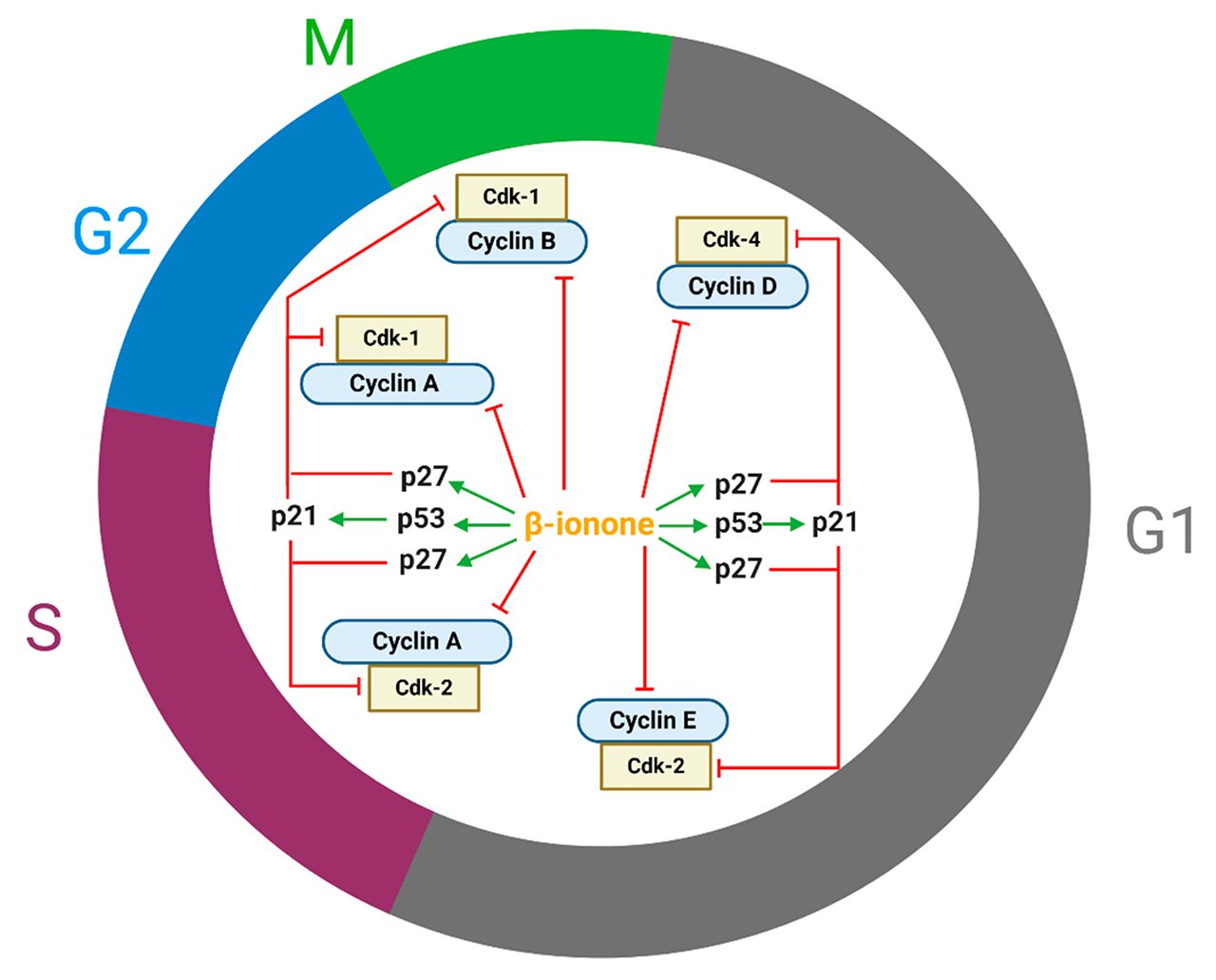
图2. β-紫罗兰酮调节几个细胞周期调节蛋白,导致各种癌细胞的细胞周期停滞(Cdk-1,细胞周期蛋白依赖性激酶-1;Cdk-2,细胞周期蛋白依赖性激酶-2;Cdk-4,细胞周期蛋白依赖性激酶-4;p27,细胞周期蛋白依赖性激酶抑制剂;p21,细胞周期蛋白依赖性激酶抑制剂)。
此外,有报道称β-紫罗兰酮增强了p27的表达,这也可以解释细胞周期停滞,从而导致细胞生长迟缓。据认为,β-紫罗兰酮在七癌认知的早期阶段针对持久性肿瘤前病变的p53。P53主要通过p21的转录激活来调节细胞周期停滞。P21和p27是CdkI,与Cdk-周期素(cyclin)复合物结合并阻断其活性,特别是涉及周期素(cyclin) A、B、D和E的复合物(图2)。此外,有人提出,细胞周期停滞可能是通过MAPK途径调节的;如Dong等人表明,β-紫罗兰酮抑制了细胞外信号调节激酶的表达,并诱导了p38和SAPK/JNK的表达。
3、凋亡的影响
β-紫罗兰酮通过诱导细胞凋亡诱导乳腺癌腺体和乳腺癌、白血病和人类胃腺癌细胞系的细胞凋亡。β-紫罗兰酮诱导的细胞凋亡是通过减少抗凋亡蛋白Bcl-2的表达和增加促凋亡蛋白Bax的表达来实现的(图3)。此外,β-紫罗兰酮增加了乳腺癌和人类胃腺癌细胞系中裂解的胱天蛋白酶(Caspase)-3的表达。据认为,在肝癌发生的早期阶段,β-紫罗兰酮针对持久性肿瘤前病变中的p53具有靶向作用(图3)。然而,β-紫罗兰酮诱导细胞凋亡的作用以前被证明是独立于突变的p53功能的。
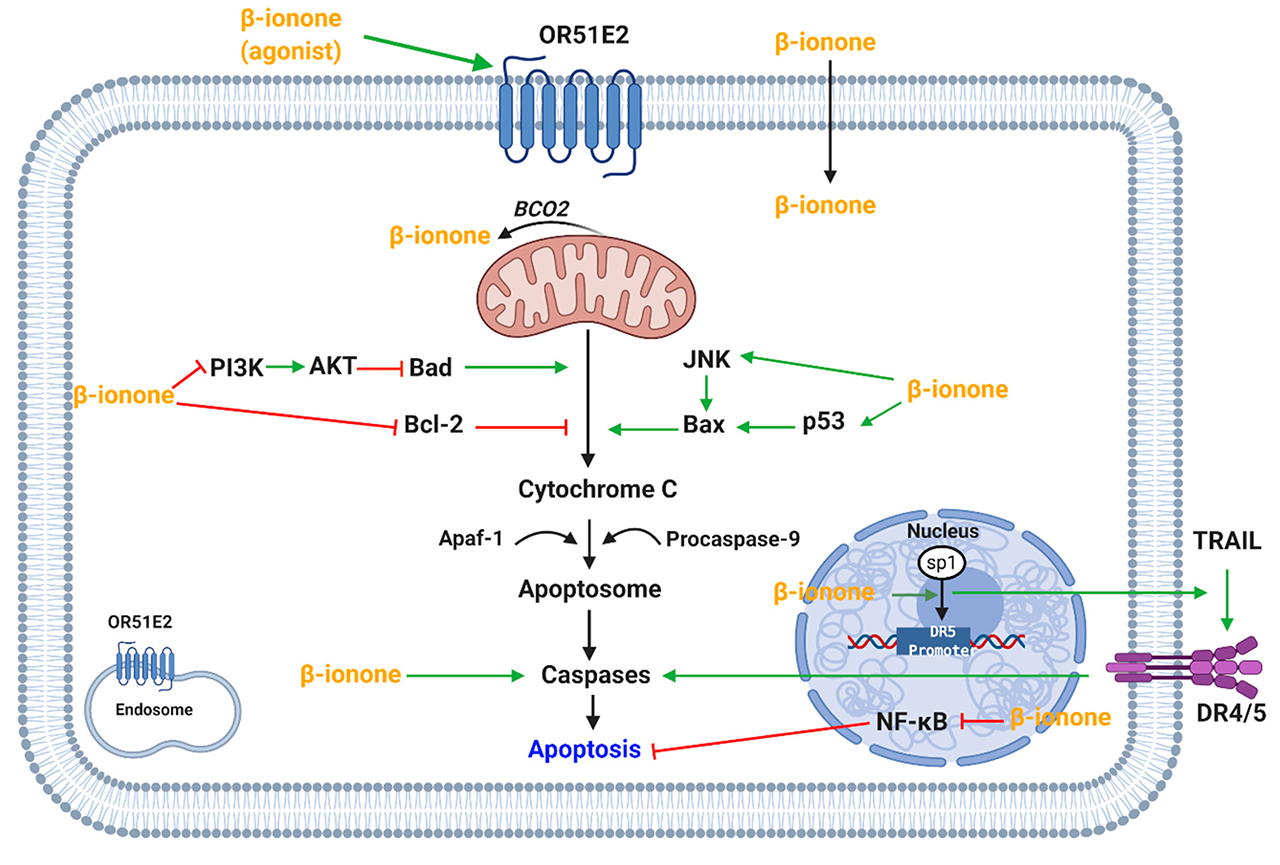
图3 β-紫罗兰酮调节促凋亡和抗凋亡通路的机制。(OR51E2,嗅觉受体51E2;BCO2, β-胡萝卜素加氧酶2;JNK, Jun氨基末端激酶;AKT,蛋白激酶B;PI3K,磷酸肌醇3-kinase;Apaf-1,凋亡蛋白酶活化因子1;TRAIL,肿瘤坏死因子相关凋亡诱导配体;DR4/5,死亡受体4/5;NF - Bк-κB核因素;转录因子SP1;特异性蛋白1;DR5启动子,死亡受体5启动子)
此外,有报道称PI3K(磷酸肌醇3-激酶)磷酸化蛋白和AKT表达水平降低。PI3K-AKT通路也可以解释细胞凋亡,该通路参与细胞增殖、生存和细胞信号转导(图3)。进一步的研究证实了MAPK通路在细胞增殖和凋亡中的作用,磷酸化p38的增加被证实。这些研究表明,细胞凋亡可能通过MAPK或PI3K-AKT途径介导。
Liu等人发现,β-紫罗兰酮对大鼠的乳腺癌发生有剂量依赖性的抑制作用;肿瘤的繁殖率下降,肿瘤出现时间增加。此外,还发现增殖细胞核抗原的减少和核分裂的增加。此外,发现β-紫罗兰酮能使细胞对TRAIL(肿瘤坏死因子相关凋亡诱导配体)刺激的凋亡敏感。这是通过增加转录因子Sp1与DR5启动子位点的直接结合,取消NF-κB的激活和减少抗凋亡蛋白的表达而介导的(图3)。另一项研究发现,β-紫罗兰酮在肝癌发生的早期阶段,针对顽固的肿瘤前病变的NF-коB。
Janakiram等人发现,β-紫罗兰酮可能通过在人类结肠癌细胞中作为视黄醇X受体-α(RXR-α)的配体而诱导细胞凋亡。β-紫罗兰酮被发现在细胞中剂量依赖性地增加RXR-α mRNA的表达水平。此外,RXR-α的表达在其他癌细胞中也被发现有所减少。值得注意的是,RXR-α mRNA的表达不仅在大鼠结肠腺癌中减少,而且在前列腺癌的基底细胞中也减少;提出它对癌症进展的影响。β-紫罗兰酮和β-胡萝卜素/维生素A之间的结构相似性进一步支持了这一点,β-紫罗兰酮被认为可以与RXRs结合。然而,β-紫罗兰酮在体内对大鼠结肠异常隐窝的影响是有争议的,因为研究报告显示对异常隐窝的抑制或没有影响。
4、HMG CoA还原酶介导的效果
3-羟基-3-甲基戊二酰辅酶A(HMG CoA)还原酶负责合成甲羟戊酸。甲羟戊酸是甾醇分子(如胆固醇)和非甾醇异构体(如多萜醇、泛醌、焦磷酸法尼基和焦磷酸香叶香叶基)的前体。胆固醇在膜的完整性中起着重要的作用,而非固醇类异戊二烯类化合物则参与了各种细胞过程。香叶香叶基焦磷酸酯和法尼基焦磷酸酯使蛋白质(翻译后修饰),如Ras、Rho和Rac GTP酶家族,这又在细胞增殖、血管生成和生存中起着重要作用。
抑制HMG CoA还原酶与细胞凋亡、细胞周期停止和增殖抑制有关。据报道,他汀类药物是公认的HMG-CoA还原酶的抑制剂,具有抗癌活性。在肿瘤细胞中,HMG-CoA还原酶对甾醇调节的反馈抑制有抵抗力(图4),因此其在各种类型的癌症中上调。然而,肿瘤细胞中的HMG CoA还原酶对由非甾醇化合物介导的转录后抑制很敏感。还发现异戊二烯类化合物可以转录后抑制HMG-CoA还原酶的活性。
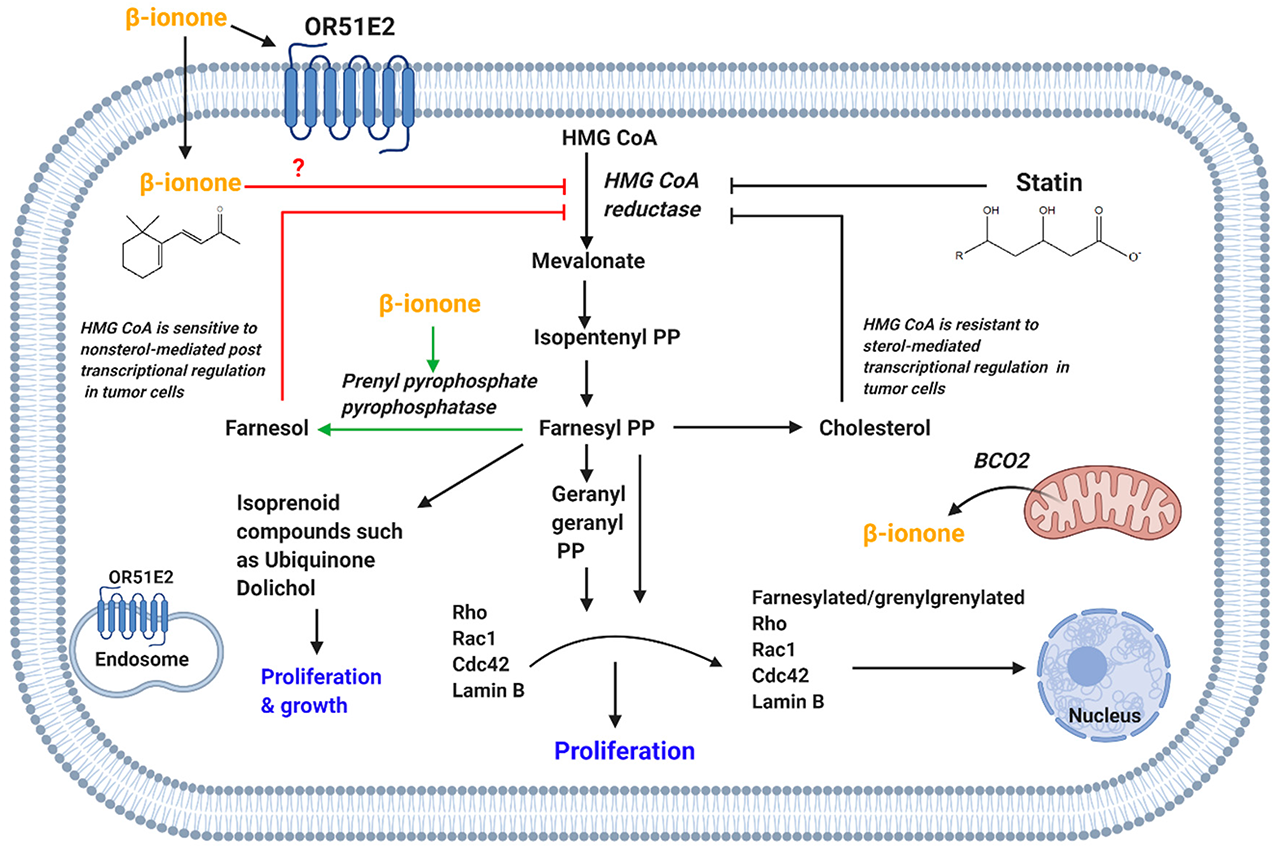
图4. β-紫罗兰酮介导的对HMG-CoA还原酶的抑制导致了抗增殖作用和胆固醇水平的降低。(OR51E2,嗅觉受体51E2;BCO2,β-胡萝卜素加氧酶-2;HMG CoA,3-羟基-3-甲基戊二酰辅酶A;PP,焦磷酸)。
饮食中的β-紫罗兰酮可以抑制鸡的血清总胆固醇水平和HMG CoA活性,同时提高HDL水平。β-紫罗兰酮对大鼠乳腺癌发生的化学预防作用与它对HMG-CoA还原酶的抑制作用平行。Espindola等人报告说,较高剂量的β-紫罗兰酮(16毫克/100克)可抑制肿瘤前病变的细胞增殖,并在肝癌发生的初始阶段引起较小的可见肝细胞结节。值得注意的是,血浆总胆固醇的水平随着更高剂量的β-紫罗兰酮的给药而下降。其他研究发现,β-紫罗兰酮对小鼠B16黑色素瘤、乳腺癌、人类白血病、人类结肠腺癌和前列腺肿瘤细胞系生长的抑制是通过降低HMG CoA还原酶的活性来实现的。β-紫罗兰酮酮与洛伐他汀或反式、反式法尼醇(参与抑制还原酶的化合物)之间报告的协同抗增殖活性进一步证实了这一点。
β-紫罗兰酮对HMG-CoA活性的抑制是通过转录后作用介导的。β-紫罗兰酮对HMG CoA活性的抑制是通过间接促进HMG CoA的降解来解释的。这是通过诱导焦磷酸戊酯焦磷酸酶的活性来介导的,而焦磷酸戊酯焦磷酸酶又会增加法尼醇的水平,法尼醇是一种非甾体的甲状腺素产物,可降解HMG CoA还原酶(图4)。此外,β-紫罗兰酮和洛伐他汀影响了核纤层蛋白B的翻译后修饰,而核纤层蛋白B是在间期组装核膜的一个重要作用。因此,有人认为β-紫罗兰酮介导的对HMG CoA-还原酶的抑制抑制了核纤层蛋白B的核定位,从而导致DNA易受内切酶的影响。这种作用将导致细胞凋亡,正如β-紫罗兰酮和洛伐他汀所描绘的那样。此外,β-紫罗兰酮和洛伐他汀引起细胞周期停止在G1期。因此,β-紫罗兰酮和斯达汀共同调节HMG-CoA和协同抗增殖作用支持β-紫罗兰酮作为癌症的辅助治疗,以减少斯达汀的副作用。
我们认为β-紫罗兰酮可能以类似于斯达汀的方式直接抑制HMG-CoA还原酶,因为β-紫罗兰酮看起来与斯达汀的药理结构有相似的骨架(图4)。此外,最近的一项研究表明,与斯达汀结构完全不同的化合物也能够抑制HMG-CoA还原酶。
尽管如此,Duncan和他的同事表明,β-紫罗兰酮可以抑制乳腺癌细胞的增殖和细胞周期,而不影响HMG CoA还原酶的活性。β-紫罗兰酮被发现具有化学保护作用,因为它减少了可见肝细胞结节的平均数量,以及持续的肿瘤前病变,在大鼠肝癌发生的整个起始阶段造成DNA损伤。值得注意的是,β-紫罗兰酮增加了肝癌大鼠的肝脏HMG-CoA还原酶mRNA水平,但降低了血浆总胆固醇的水平。这种还原酶mRNA水平的增加可能是HMG CoA降解后的一种补偿机制。法尼醇对HMG CoA还原酶和胆固醇有类似的影响,这支持了所记录的法尼醇可以调节β-紫罗兰酮的活性的结论。
5、抗氧化剂介导的效果
Asokkumar提出,β-紫罗兰酮的抗增殖活性可归因于其抗氧化特性。苯并(a)芘是一种著名的致癌物,被选择来诱发小鼠肺癌,因为它被认为会产生活性氧并启动增殖变化。β-紫罗兰酮的抗增殖作用是通过减少增殖细胞核抗原的表达和恢复癌症标志酶(癌胚抗原和神经元特异性烯醇化酶)的正常水平来显示的。对小鼠施用β-紫罗兰酮可使酶(如过氧化氢酶、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽-S-转移酶、谷胱甘肽还原酶(GR)和超氧化物歧化酶(SOD))和非酶抗氧化剂(如谷胱甘肽(GSH)、维生素E和C)的活性恢复到苯并(a)芘处理前的水平(图5)。
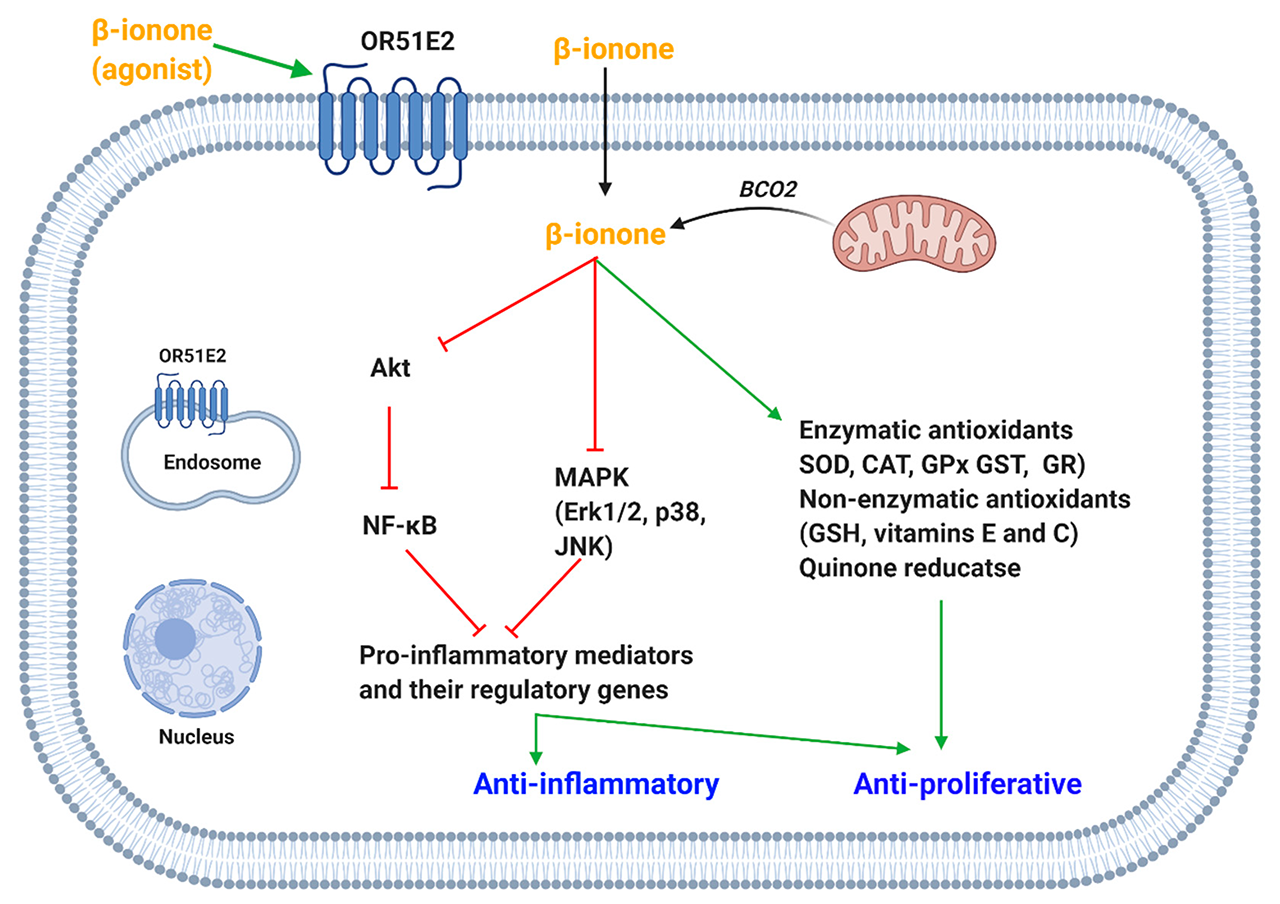
图5. β-紫罗兰酮抑制促炎症介质和诱导/恢复抗氧化剂引起抗增殖和抗炎作用。(OR51E2,嗅觉受体51E2;BCO2,β-胡萝卜素氧合酶-2;MAPK,有丝分裂原激活的蛋白激酶;JNK,Jun氨基末端激酶;AKT,蛋白激酶B;NF-кB,核因子-κB。Erk1/2,细胞外信号调节激酶1/2;SOD,超氧化物歧化酶;CAT,过氧化氢酶;GPx,谷胱甘肽过氧化物酶;GST,谷胱甘肽-S-转移酶;GR,谷胱甘肽还原酶;GSH,谷胱甘肽)。
另一项研究表明,β-紫罗兰酮具有化学保护作用,并抑制了7,12-二甲基苯(a)蒽诱导的大鼠乳腺癌的发生。它增加了抗氧化酶(GPx、GR、SOD)和GSH的活性。β-紫罗兰酮的抗氧化作用进一步得到了脂质过氧化、丙二醛(氧化应激的标志物)和一氧化氮(一种活性氮物种)的减少的证明。Dong等人表明,在Hepa1c1c7细胞上应用β-紫罗兰酮可以增强醌还原酶的活性,这是一种第二阶段的解毒酶。β-紫罗兰酮如何产生抗氧化作用的确切机制仍不清楚。然而,对醌还原酶的影响可能是通过对p38的调节来解释的,p38是第二阶段解毒酶激活的一个负面调节器。
6、促炎症分子介导的影响
β-紫罗兰酮抑制COX-2在人类胃癌细胞和大鼠乳腺肿瘤组织中的表达,这可能解释了其抗增殖作用。此外,人胃癌细胞中前列腺素E2(PGE2)的释放也有所减少。Kang支持β-紫罗兰酮对脂多糖(LPS)诱导的促炎症介质的表达有抑制作用。据报道,在LPS诱导的BV2小胶质细胞中,β-紫罗兰酮减弱了一氧化氮(NO)、前列腺素E2(PGE2)和肿瘤坏死因子-α(TNF-α)的释放以及诱导性NO合成(iNOS)、环氧化酶-2和TNF-α的蛋白质和mRNA表达。研究发现,β-紫罗兰酮通过抑制NF-κB和MAPK途径调节这些炎症介质(图5)。作者表明,β-紫罗兰酮通过延缓Akt的活性降低了NF-κB的DNA结合活性。此外,β-紫罗兰酮抑制了MAPKs(Erk、p38和JNK)的磷酸化,而MAPKs是释放促炎症介质的重要调节器。
7、抗菌作用
Griffin和他的同事研究了结构基团在决定几种萜类化合物的抗菌活性中的作用。β-紫罗兰酮对大肠杆菌和白色念珠菌有抑制活性。β-紫罗兰酮抑制了黄曲霉的生长和黄曲霉和寄生虫的孢子繁殖。此外,暴露在β-紫罗兰酮下,无性繁殖结构的形态发生了改变。值得注意的是,黄曲霉的孢子中的黄曲霉毒素积累量急剧减少。
8、α-紫罗兰酮
如前所述,β-紫罗兰酮作为OR51E2的激动剂。另一方面,α-紫罗兰酮对OR51E2的活性并不明确。一些研究报告说,α-紫罗兰酮拮抗OR51E2,它阻止或抑制了β-紫罗兰酮的作用,特别是它被用来证实OR51E2被β-紫罗兰酮激活。例如,Neuhaus发现α-紫罗兰酮对细胞内钙浓度没有影响,它抑制了β-紫罗兰酮诱导的细胞内钙的增加和对前列腺癌细胞的抗增殖作用。
相反,Sanz等人表明,α-紫罗兰酮是OR51E2的真正激动剂。值得注意的是,α-紫罗兰酮主要诱导LNCaP细胞和小鼠前列腺肿瘤的生长,而β-紫罗兰酮则增加细胞的侵袭性。这些发现与GPCR的偏向激动现象相一致。因此,有人提出,每种离子素诱导不同的下游信号级联,取决于G蛋白或β-抑制蛋白(arrestin)的耦合。
此外,α-紫罗兰酮根据其剂量引起不同的反应;中等剂量可增强LNCaP细胞的侵袭性,而高剂量则没有(相反,它可维持细胞生长)。有人提出,α-紫罗兰酮会根据剂量的不同调节不同的细胞信号级联。例如,α-紫罗兰酮可能部分或完全激活了OR51E2,从而引发了不同的下游信号级联。这也可能意味着α-紫罗兰酮在较高的剂量下会拮抗OR51E2。然而,在转染的HEK293细胞中,较高剂量的α-紫罗兰酮激活OR51E2支持前一种假设。
紫罗兰酮,特别是β-紫罗兰酮,可以通过BCO2内源性产生或通过饮食外源性提供。无论是内源性的还是外源性的,β-紫罗兰酮都具有抗癌、化学预防、抑制黑色素生成、抗炎和抗菌的活性。β-紫罗兰酮通过激活OR51E2和调节HMG CoA还原酶、细胞周期调节蛋白、促凋亡和抗凋亡途径、促炎症细胞因子和抗氧化酶来介导这些作用。OR51E2的激活导致调节各种激酶的活性和细胞内钙离子的增加。OR51E2的激活导致前列腺癌细胞的抗增殖作用和转移,黑色素细胞的抗增殖作用和黑色素生成以及视网膜色素上皮细胞的增殖和转移。
归因于β-紫罗兰酮的广泛效应和各种信号级联可能是由于不同的细胞汇合体而产生。此外,β-紫罗兰酮可能与广泛的受体相互作用,不限于OR51E2,如报道的与AR和RXR-α的相互作用。此外,β-紫罗兰酮可能在不同的细胞内区划中激活细胞质OR51E2。这是基于β-紫罗兰酮的疏水特性,使其能够穿越细胞膜。
β-紫萝兰酮和α-紫罗兰酮衍生物表现出抗炎、抗微生物和抗癌作用。建议进一步研究β-和α-紫罗兰酮衍生物与各种报道的生理作用之间的结构活性关系。然而,大多数研究都同意,连接在β-紫罗兰酮上的环状分子上的电子抽出取代基会产生更好的抗癌和抗微生物活性。
总的来说,这些数据表明,β-紫罗兰酮是一个有前途的治疗癌症、炎症和传染病研究的骨架结构,因此它不仅仅是一个紫罗兰的香味。
参考文献
[1] Rose (Rosa damascena) , John C. Leffingwell
[2] NODA, C., ALT, G. P., WERNECK, R. M.; 等. Aldol Condensation of Citral with Acetone on Basic Solid Catalysts. Braz. J. Chem. Eng. 1998, 15 (2). doi:10.1590/S0104-66321998000200004.
[3] Alfred Russell and R. L. Kenyon. Pseudoionone. Organic Syntheses, Coll. Vol. 3: 78. [2013-09-15].
[4] Elisabetta Brenna, Claudio Fuganti, Stefano Serra, and Philip Kraft, Optically Active Ionones and Derivatives: Preparation and Olfactory Properties, Eur. J. Org. Chem., 2002, S. 967–978.
[5] Aloum L, Alefishat E, Adem A, Petroianu G. Ionone Is More than a Violet’s Fragrance: A Review. Molecules. 2020; 25(24):5822. https://doi.org/10.3390/molecules25245822