服务热线
177-5061-9273

中文名:橙花醇,顺-3,7-二甲基-2,6-辛二烯醇。
英文名:cis-3,7-Dimethyl-2,6-octadienol ,Nerol,Vernol,Lorena。
化学名:(Z)-3,7-dimethylocta-2,6-dien-1-ol
Bp: 225~226
UV: λ 195nm
纯度:92%
其中Nerol,Vernol,Lorena为一些香料公司的商品名称。香料工业中通过合成法获得的橙花醇都会伴随有香叶醇的存在,可以通过高效的塔板精馏获得较纯的橙花醇。
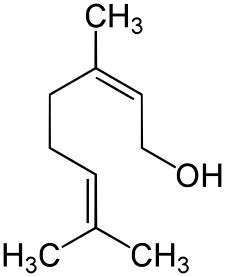
橙花醇的分子结构式
概况
橙花醇(英文:Nerol)又称β-柠檬醇,是系香叶醇的同分异构体(反式,香叶醇为顺式),是一种单萜醇。无色渍状液体,有玫瑰和橙花的香气。无旋光性。几乎不溶于水,与乙醇、乙醚、氯仿混溶。容易失水生成苧烯。

天然橙花醇及其酯类存在于橙叶油、玫瑰油、薰衣草油、斯里兰卡香茅油、苦橙花油和香柠檬、柠檬、白柠檬、柚子、甜橙等中。
理化指标
外观:无色液体。
香气:有令人愉快的玫瑰和橙花的香气,香气较平和,微带柠檬样的果香,橙花醇是香叶醇的异构体,其香气比香叶醇柔和优美,相对偏清,并带有新鲜的清香和柑橘香调。
比重(25/25℃):0.873~0.891 。
熔点(℃):低于~1.5 。
沸点(℃):225~227 。
折光率(20/20℃):1.462--1.478 。
化学性质
橙花醇含有双键和醇羟基,能发生取代反应和加成反应;
在浓硫酸催化下加热脱水,发生消去反应,能生成2种四烯烃;
1mo1橙花醇在氧气中充分燃烧,需消耗470.4ML氧气(标准状况);
1mo1橙花醇在室温下与溴四氯化碳溶液反应,最多消耗3mol溴,480g溴。
用途
橙花醇是一种贵重的香料。用于配制玫瑰型和橙花型等花香香精。类别:存在于橙花油、玫瑰油等中。橙花醇是一种具有玫瑰花香的香精原料,在饮食、食品、日化高档香精的调配中被广泛使用。同时也是合成另一些重要香料的中间品,且是合成这些重要香料的关键原料。目前全球年需求量在5000吨左右,其中我国的需求量也不低于500吨,而全世界的生产能力只有3000吨左右。
GB2760-1996规定为允许使用的食用香料。主要用以配制覆盆子、树莓、草莓和柑橘类等水果型香精,是配制橙花、玫瑰、玉兰香精的主要香料。是茉莉、白花、紫丁香、铃兰、水仙、香石竹、含羞花、紫罗兰花、香罗兰、草兰、晚香玉以及柑橘古龙型中常用的香料。也常用于风信子、栀子桂花、金合欢等香精配方中。
毒性
GRAS(FEMA):LD504500mg/kg(大鼠,经口)。
使用限量
FEMA(mg/kg):软饮料1.4;冷饮3.9;糖果16;焙烤食品19;布丁类1.0~1.3;胶姆糖0.80。适度为限(FDA§172.515,2000)。
橙花醇的制备及合成
1、碳基负载的柠檬醛选择性加氢催化剂研究
这个过程如图1所示,涉及到β-蒎烯的热解,将其在550-600℃下通过一个管子,接触时间很短,就可以得到90%的月桂烯。然后,在第二步(月桂烯氢氯化)中,在少量氯化亚铜催化剂和有机季铵盐的存在下,将氯化氢加入到月桂烯中,在烯丙基双键处进行优先加成,从而形成较高比例的香叶基或橙花基氯化物、芳樟基氯化物和少量的月桂烯基氯化物。去除催化剂后,通过加入带有相转移催化剂(PTC)的乙酸钠或甲酸钠,或在氮气的存在下,将氯化物的粗混合物转化为乙酸盐(或甲酸盐)的混合物,主要得到乙酸香叶酯(50%-55%)、乙酸橙花酯(40%-50%)和少量乙酸芳樟酯。醋酸盐或甲酸盐的皂化可以得到相应的醇和醋酸盐或甲酸钠,后者被回收利用。对粗制的醇混合物进行分馏可以得到香叶醇和橙花醇产品,通常是混合物。进一步分馏可得到约98%的香叶醇。工业制造过程的缺点是需要许多阶段,包括热解,它的困难是需要大量的试剂,并相应的在每个阶段会产生损失。因此,柠檬醛的选择性加氢是一种较为可行的单步合成方法。此外,最近石油化学方法已经大量生产了柠檬醛,因此,柠檬醛的部分氢化已经成为一种非常经济的生产香叶醇和橙花醇的方法。因此,柠檬醛的氢化反应引起了世界各国科学家的广泛关注。柠檬醛(3,7-二甲基-2,6-八烯醛)是植物和柑橘类水果中发现的一种单萜。它是无环醛类香叶醛(柠檬醛E)和橙花醛(柠檬醛Z)的异构体混合物。
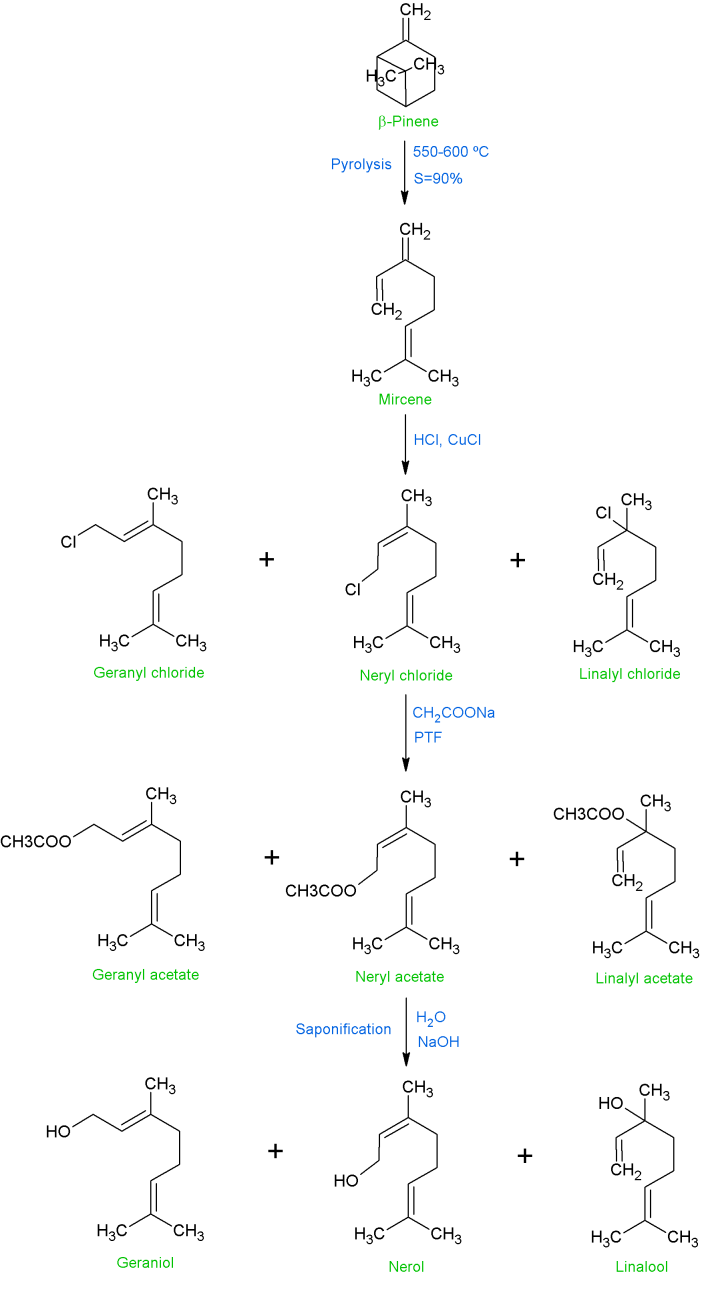
图1 橙叶醇、香叶醇的工业化生产工艺。由国际香精香料(IFF)、Pinova和Dérivés Tecnal Résiniques et Terpéniques (DRT)提供。[1]
柠檬醛选择性氢化成橙花醇和香叶醇并不容易,因为柠檬醛是α,β不饱和醛,具有三个可以氢化的双键:除了共轭键C=O和C=C外,还有一个孤立的C=C键。一个完整的反应方案如图2所示。热力学倾向于C=C键的氢化反应,而由于动力学原因,C=C键比C=O基团更活泼。因此,在大多数基于VIII族元素的单金属催化剂存在的情况下,可以得到饱和醛或醇。因此,挑战在于有选择性地增强C=O键的氢化反应生成香茅醇和香叶醇,同时减少相应共轭C=C键的氢化反应,从而减少香茅醛的形成,而更困难的是,避免连续加氢生成单一不饱和或饱和醇(分别为香茅醇和3,7二甲基辛醇),以及避免产生异丙酚及其饱和醇薄荷醇的环化路线。最后,使用某些反应介质也会发生其他不希望发生的反应,如醇类,它可以产生香茅醛缩醛。因此,只有对催化剂进行优化设计,才能实现对香叶醇和橙花醇的高选择性加氢反应。目前,针对这一目标更广泛的提议转向激活C=O基团的吸附模式和/或阻止C=C基团的吸附模式。这样,图3显示了柠檬醛分子的不同吸附模式。[1]
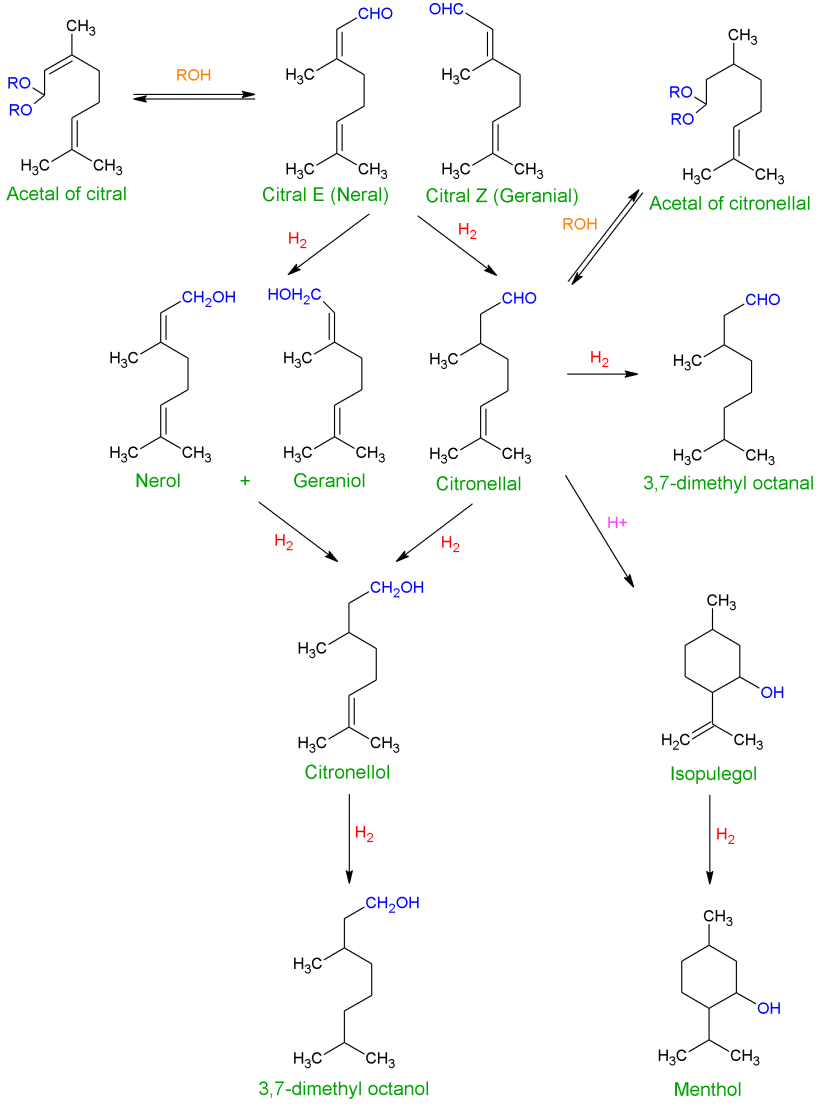
图2 柠檬醛加氢反应方案 [1]
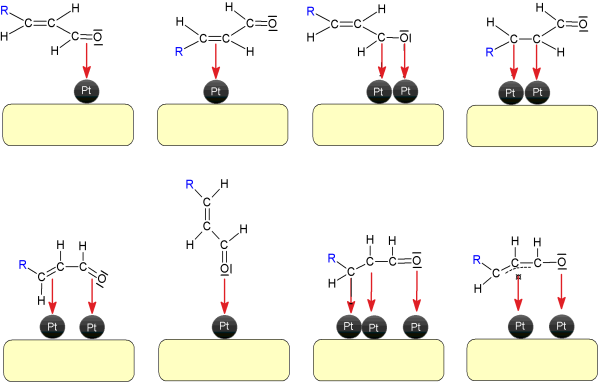
图3 α、β不饱和醛分子的吸附模式[1]
2、代谢工程大肠杆菌从葡萄糖中合成橙花醇的研究 [2]
本研究首次在代谢工程的大肠杆菌中从葡萄糖中生物合成了橙花醇。首先表达截短的橙花基二磷酸合酶基因tNDPS1,催化异戊烯基二磷酸(IPP)和二甲基烯丙基二磷酸(DMAPP)生成橙花基二磷酸(NPP),然后共表达橙花基二磷酸合酶基因GmNES,由NPP合成最终产物橙花基二磷酸。工程菌LZ001累积橙花醇浓度为0.053 ± 0.015 mg/L。其次,通过共同表达IDI1、MVD1、ERG8、ERG12、tHMG1和ERG13来增加IPP和DMAPP的供应。通过过表达外源ERG10基因,重组菌株LZ005摇瓶培养产生的橙花醇浓度为1.564 ± 0.102 mg/L,比LZ001提高了29.51倍。本研究为橙花醇的生物合成提供了新的方法,为萜类化合物的生产提供了新的代谢工程策略。[2]
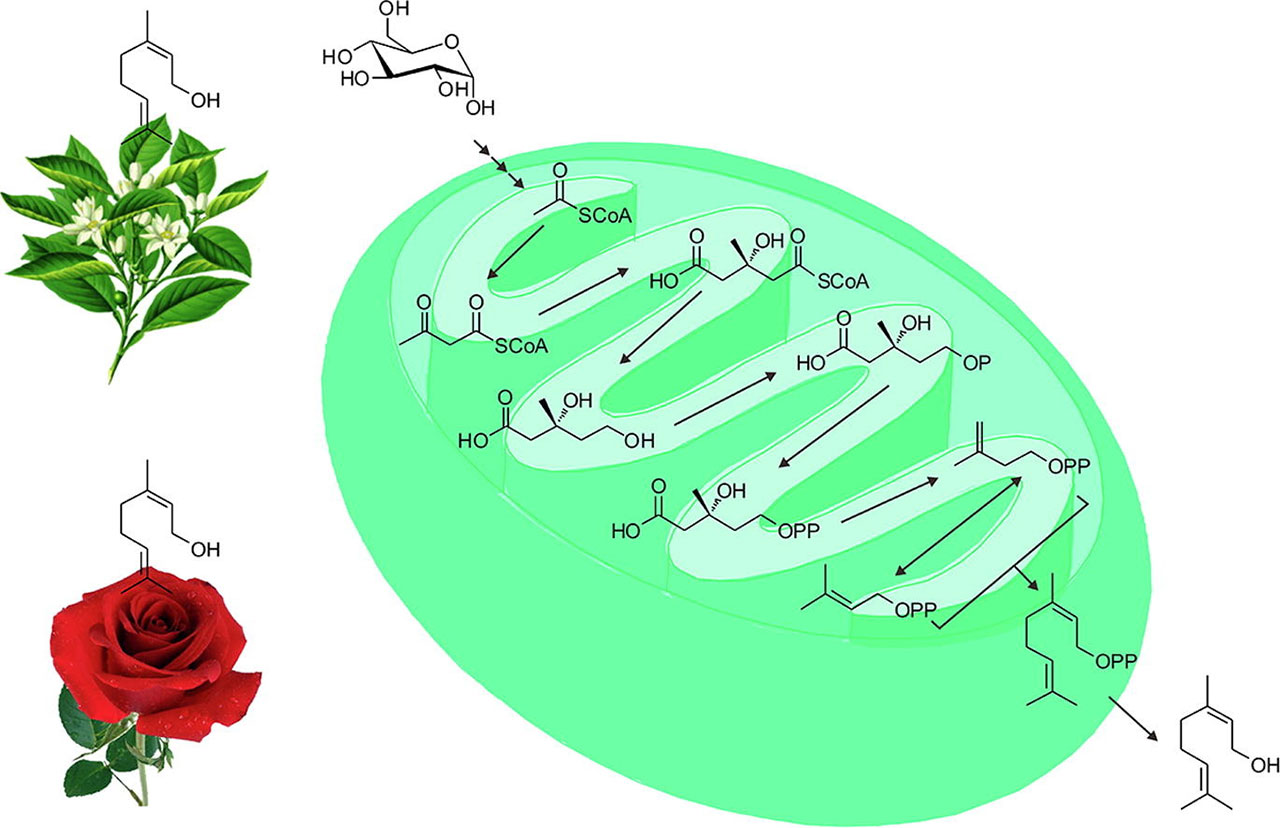
图4 代谢工程大肠杆菌从葡萄糖中合成橙花醇的路线图 [2]
3、耐多胁迫的季也蒙毕赤酵母(Meyerozyma guilliermondii GXDK6)合成橙花醇
如图5所示,糖酵解或柠檬酸循环的上游来源1-脱氧-d-木酮糖- 5-磷酸、香叶基二磷酸或芳樟醇橙花醇,首先转化为最终的香叶酸或8-氧香叶醛。在这一过程中,参与橙花醇合成的蛋白质有香叶基二磷酸酶、单三苯二磷酸酶和香叶醇异构酶。参与橙花醇代谢转化的蛋白有香叶醇8-羟化酶、醇脱氢酶和香叶醇脱氢酶。Zong等报道,代谢工程大肠杆菌从积累量为0.053±0.015 mg/L的葡萄糖中生物合成了橙花醇,并揭示了其生物合成机理。将剪短的橙花基二磷酸合酶基因tNDPS1经IPP和DMAPP催化形成橙花基二磷酸(NPP),再将橙花基二磷酸合酶基因GmNES共表达,以NPP为原料合成橙花基二磷酸。以葡萄糖为底物发酵GXDK6时,橙花醇的积累量为~2.740 mg/L (p<0.05),高于大肠杆菌发酵时的积累量,而在本地季也蒙毕赤酵母中,橙花醇的生物合成机理尚未见报道。进一步研究了这6个蛋白的结构和功能(图5),结果表明香叶酰基二磷酸酶是一个约65 kDa的二聚体蛋白,其配体为Mn2+(图5b),说明香叶酰基二磷酸酶可以与Mn2+结合并相互作用。并促进了催化反应产生更多的橙花醇。单萜烯基二磷酸酶也是一种二聚体蛋白,分子量约为68 kDa,但尚未找到相应的配体(图5c),说明它应该是一种具有辅助催化作用的非变构酶。香叶醇异构酶是一种约44 kDa的五聚体蛋白(图5d),其对应的配体为香叶醇(非金属离子配体未显示),说明香叶醇的存在有利于催化反应。综上所述,这些蛋白质是不可缺少的,直接参与了橙花醇的调控和生物合成。香叶醇8-羟化酶、醇脱氢酶和香叶醇脱氢酶催化橙花醇的后续代谢或转化。其中,香叶醇8-羟化酶是一个分子量约为55 kDa的单体蛋白,其配体尚未发现(图5e)。醇脱氢酶也是一种分子量为~39 kDa的单体蛋白,其配体为Zn2+(图5f),说明醇脱氢酶可以与Zn2+结合并相互作用,有助于橙花醇的形成。香叶醇脱氢酶是一种约41 kDa的二聚体蛋白,尚未找到相应的配体(图5g),说明它可能是一种具有辅助催化作用的非变构酶。这些证据表明,橙花醇的产生主要是由于GXDK6中存在相应的酶系统和代谢途径。此外,橙花醇被归类为GXDK6中芳香代谢物的典型例子,GXDK6能够长期保持香气产生,应该是各种芳香代谢物的贡献。因此,橙花醇的生物合成机制将有助于更好地理解GXDK6的产香机制。[3]
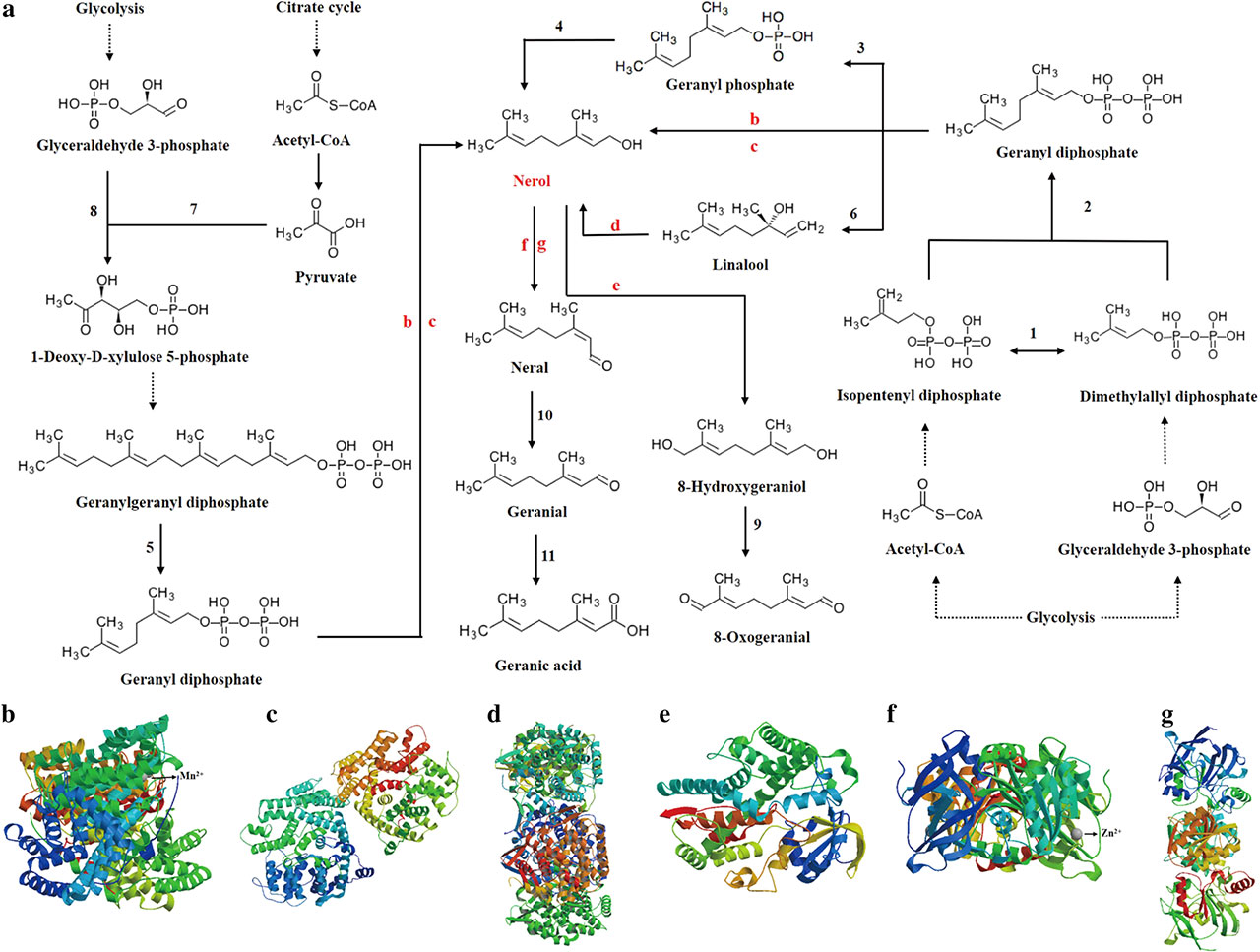
图5 橙花醇在GXDK6中的代谢途径及其相关调控蛋白。a.橙花醇的代谢途径;b.香叶基二磷酸酶;c.单萜烯基二磷酸酶;d.香叶醇异构酶;e.香叶醇8-羟化酶;.f.乙醇脱氢酶;g.香叶醇脱氢酶 [3]
橙花醇的药理及生物学活性
1、橙花醇可减弱奥巴因诱导的心律失常
橙花醇(C10H18O)是一种单萜类化合物,存在于许多精油中,如柠檬香脂和啤酒花。在这项研究中,我们探讨了橙花醇的收缩性和电生理特性,并证明了它在豚鼠心脏治疗中的抗心律失常作用。橙花醇对心房和心室组织收缩力、心电图(ECG)、电压依赖性L型Ca2+电流(ICa,L)和奥巴因触发的心律失常的影响进行了评估。总的来说,我们的结果显示,通过增加橙花醇的浓度(从0.001到30mM),左心房的收缩力明显下降。这种影响在冲洗后(2分钟)完全并迅速可逆。肾上腺素(3mM浓度)减少了通过在细胞外介质中加入CaCl2而诱发的左心房正性肌力反应。有趣的是,当使用较低浓度的橙花醇(30 /span>M)时,不可能清楚地观察到任何明显的心电图信号改变,但观察到心室收缩力的小幅下降。此外,300/span>M的橙花醇促进了心率和收缩力的明显下降。值得注意的是,在分离的心肌细胞中,灌注300 /span>M橙花醇后,ICa,L峰值降低了58.9 ± 6.31%(n=7,p<0.05)。30和300 /span>M的橙花醇延迟了奥巴因触发的心律失常的发生时间,并促使奥巴因(50 /span>M)的存在所引起的舒张期张力下降。此外,肾上腺素预孵化明显减弱了心律失常的严重程度指数,而由奥巴因暴露引起的正性肌力却没有变化。综上所述,我们可以得出结论,橙花醇主要是通过L型Ca2+通道阻断减少Ca2+的流入,减轻了奥巴因触发的哺乳动物心脏心律失常的严重程度。
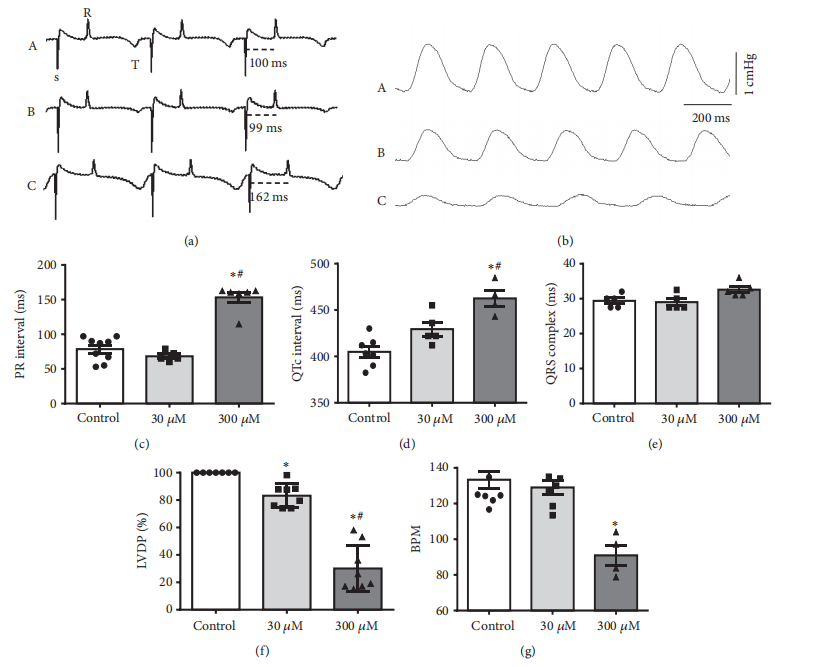
图6 橙花醇对豚鼠离体心脏的心电图参数和左心室发育压力(LVDP)的影响。(a) 对照组(A)、30 /span>M(B)和300 /span>M橙花醇(C)的心电图的代表性痕迹。(b) 对照组(A)、30 /span>M(B)和300 /span>M(C)橙花醇灌注10分钟后,LVDP的代表性记录。(c) 橙花醇对PR间期、(d)QTc间期、(e)QRS波段持续时间、(f)LVDP和(g)心率(BPM)的影响。数据表示为平均值±SEM(n=4-9,∗p<0.05与对照组相比,#p<0.05与30 /span>M橙皮醇相比)。单向方差分析,然后进行Tukey的事后检验。
2、评价橙花醇在小鼠体内的神经药理特性
寻找能够为人类提供基础并改善其生活质量的治疗剂是不间断的。橙花醇(顺式-2,6-二甲基-2,6-辛二烯-8-醇)是一种单萜类化合物,可以在各种药用植物如Lippia spp和Melissa officinalis L.中找到。本研究的目的是通过对小鼠进行行为测试(开放场地、高架迷宫、光/暗和轮棒测试)来分析橙花醇对中枢神经系统的急性影响。我们使用了雄性白化病小鼠(Mus musculus),瑞士品种,成年和2个月大,每个实验方案将动物分为五组(n = 8),分别腹腔注射Tween 80 0.05%溶于0.9%生理盐水、橙花醇(30、60或90 mg/kg)或苯甲二氮䓬(一种安定片,diazepam(2 mg/kg))。在开放场地测试中,与对照组相比,所有用橙花醇处理的组别都显示出运动活动的明显减少(越过、追赶和梳毛的次数)。在高架迷宫试验中,与对照组相比,橙花醇组明显增加了进入的次数和在开放臂中停留的时间。在明暗测试中,与对照组相比,橙花醇组显示出在房间内的停留时间有明显增加。在旋转杆测试中,与对照组相比,使用橙花醇的组别在旋转杆上花费的时间和跌倒的次数上没有显示出变化。这些结果表明,橙花醇对小鼠可能具有抗焦虑的作用。[5]
参考文献
[1]. Bailón, Esther & Maldonado-Hódar, Francisco José & Perez-Cadenas, Agustin & Carrasco-Marín, Francisco. (2013). Catalysts Supported on Carbon Materials for the Selective Hydrogenation of Citral. Catalysts. 3. 853-877. 10.3390/catal3040853.
[2]. Zhen Zong, Qingsong Hua, Xinyu Tong, Dongsheng Li, Chao Wang, Daoyi Guo, Zhijie Liu,Biosynthesis of nerol from glucose in the metabolic engineered Escherichia coli,Bioresource Technology,2019, 287,121410,doi.10.1016/j.biortech.2019.121410.
[3]. Mo, X., Cai, X., Hui, Q. et al. Whole genome sequencing and metabolomics analyses reveal the biosynthesis of nerol in a multi-stress-tolerant Meyerozyma guilliermondii GXDK6. Microb Cell Fact 20, 4 (2021). https://doi.org/10.1186/s12934-020-01490-2
[4]. José Evaldo Rodrigues de Menezes-Filho,Diego Santos de Souza,ArturSantos-Miranda,Valeska Moraes Cabral,José Nilson Andrade Santos,Jader dosSantos Cruz,Andreza Melo de Araujo, and Carla Maria Lins de Vasconcelos. NerolAttenuates Ouabain-Induced Arrhythmias. Evidence-Based Complementary andAlternative Medicine, 2019, Article ID 5935921, 9 pages.
https://doi.org/10.1155/2019/5935921
[5]. Marques, Thiago & Marques, M.L.B.G.C.B & Lima, Douglas & Siqueira, Hálmisson & Neto, José & Branco, M.S.B.G.C. & Souza, Alexandre & Sousa, Damião & Freitas, Rivelilson. (2013). Evaluation of the neuropharmacological properties of nerol in mice. World Journal of Neuroscience. 03. 32-38. 10.4236/wjns.2013.31004.