服务热线
177-5061-9273

樟脑,又称莰酮、龙脑酮(Borneon);是从龙脑氧化后所获得的产物,天然樟脑是右旋光性,若化学合成则是消旋品。
| 中文名称 | 右旋樟脑 |
| 英文名称 | (+)-Camphor |
| 精油来源 | 樟树(本樟)、头状薰衣草、西洋耆草、樟脑迷迭香 |
| 气味描述 | 强烈又刺激的甜味,有点汽油味 |
| 芳疗功效 | 1.局部抗发炎、止痒、局部麻醉止痛,应用在各种发痒皮肤病,能迅速解除患部不适 |
| 2、强心活血,应用在肌肉关节疼痛、退化性关节炎等筋骨问题 | |
| 3、用于居家环境,可强力驱虫(蟑螂)、防蛀(白蚁)、防腐(微菌) | |
| 心灵功效 | 防止岁月的蛀虫啃食自己的心灵,预防因循苟且、食古不化 |
| 注意事项 | 1、高浓度涂抹皮肤会造成接触性皮肤炎;高浓度口服会造成恶心、呕吐、头晕、神经抽搐、痉挛、癫痫、蚕豆症禁用;2、孕妇禁用,樟脑物质会穿透胎盘、影响胎儿神经发展,甚至造成流产;3、 婴幼儿禁用。其口服致死量为1g/kg,高浓度外围可能造成呼吸困难、昏迷 |
樟脑,IUPAC名称1,7,7-三甲基二环[2.2.1]庚烷-2-酮,是一种萜类有机化合物,室温下为白色或透明的蜡状固体,可用于驱离蠹鱼,但对蟑螂、蚊子等居家常见生物没有显著驱离作用。在历史上,樟脑使用在制药用途,也是重要的军火及工业原料。在塑胶石化工业尚未普及时,樟脑为制作塑化材质重要的原料,如赛璐珞底片。诺贝尔在1887年以樟脑为原料研制出了威力更强的新式火药“无烟火药”,使樟脑成为国际贸易中关注的重要资源。
樟脑提炼自樟树干中,树龄越老的樟树所富含的樟脑比例越多。提炼方法为将树干切成小块用水蒸馏,樟脑油受热后随着水蒸汽上升,在接触到预先放置在上方的陶缸冷却后便可形成樟脑。
台湾早期北部、中部山林多为原始樟树林,老樟树树龄千年以上者甚多,在十九世纪后半叶及二十世纪初,台湾山林的樟树林成为国际贸易中关注的重要资源。汉人巨商垦民、英国商人、清廷政府、日本政府先后在台湾大量砍伐樟脑输出,台湾樟脑输出量在日治时曾达世界首位,有“樟脑王国”之称。
过去使用的樟脑丸多使用萘与萘酚,因此又称为萘丸;由于萘有一定毒性且可能致癌,现在则大部分被对二氯苯所取代,而不使用樟脑。
樟脑结构式
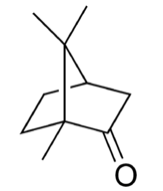
| CAS号 | 76-22-2 464-48-2((S)) 464-49-3((R)) 21368-68-3 [76-22-2] [464-49-3] ((1R)-樟脑) [464-48-2] ((1S)-樟脑} |
| PubChem | 2537 9543187((R)) 10050((S)) |
| ChemSpider | 2441, 7822160 (R), 9655 (S) |
| 化学式 | C10H16O |
| 摩尔质量 | 152.23 g·mol⁻¹ |
| 外观 | 白色或无色晶体 |
| 密度 | 0.990 |
| 熔点 | 179.75 °C (453K) |
| 沸点 | 204 °C (477 K) |
| 溶解性(水) | 0.12 g / 100 ml |
| 溶解性(氯仿) | ~100 g / 100 ml |
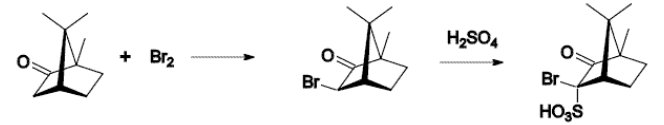
反应
樟脑可发生的典型反应有:
溴化反应:
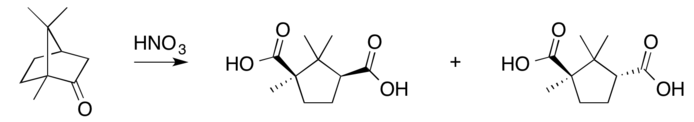
硝酸氧化:
生成异亚硝基樟脑
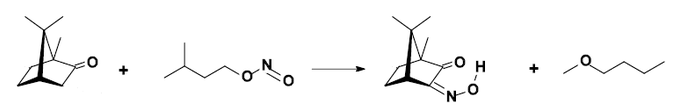
以硼氢化钠还原樟脑可得(异龙脑)冰片。
生物合成
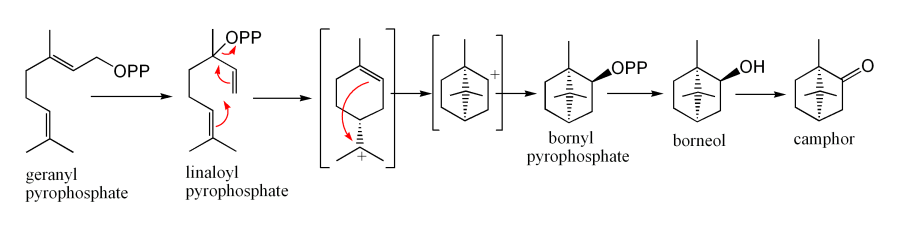
用途
樟脑的用途很多,除了使用在制药用途上,也是重要的工业原料。在早期塑胶较不普及时,樟脑为制作底片重要的原料,当时台湾输出的樟脑达到世界第一,其中北部以三角涌(今三峡)、大嵙崁(今大溪)、咸菜瓮(今关西),及中部南投的集集等地为樟脑产出最兴盛的地区。樟脑一般制成樟脑丸,用于驱虫、除臭。樟脑具毒性,不可直接食用。
对于有六磷酸葡萄糖去氢素(G6PD)缺乏症(通称蚕豆症)的患者,建议勿接触或使用含樟脑 (camphor) 之外用药品。
1887年诺贝尔利用樟脑研制出了新式火药,烟雾较少的“无烟火药”,此种火药威力更强,能使敌方不容易发现自己。
历史
6世纪时阿拉伯发明了樟脑制法,16世纪时传入日本,当时主要产地为萨摩藩(现鹿儿岛县)。当时樟脑之主要用途为赛璐珞的可塑剂,随后以樟脑为原料威力更强的新式火药发明后,需求量大增。
台湾早期北部、中部的浅山森林多为原始千年樟树林,自荷治时期以来,就有樟脑出口,当时平地甚至延伸至海岸都有浓密的樟树林。18世纪初清廷将樟树贸易收归国有专卖,私砍林木可被处死,单单1720年就因私砍林木而有超过200个人被斩首,后来引爆了朱一贵事件。事平后政策才松绑,缴交规费即可取得进入樟木林工作的许可。初期山林土地的所有人平埔族尚能收取垦民缴交的规费,到了19世纪初,汉人即渐渐夺取山林所有权及樟树贸易的独占地位。
在十九世纪后半叶及二十世纪初,台湾樟脑生产量几乎占全世界的一半以上,台湾山林的樟树林成为国际贸易中关注的重要资源。1855年台湾当地官员与美商私订密约,1858年天津条约将台湾(今台南安平)开放为通商口岸,随后又增开淡水、打狗(今高雄港)、鸡笼(今基隆港)等口岸,美商与俄商、德商、英商等即先后进入台湾收购樟脑进行樟脑出口贸易。为垄断樟脑独占地位,台湾当地官员亦欲介入利益,在1863年违反天津条约将樟脑改为官办专卖,与英商间不断的冲突在1868年引发与英军的樟脑纠纷。
1880年代台湾建省首任巡抚刘铭传与地方巨商,为掠夺山林资源、垄断樟脑独占利益(刘铭传在奏折中自称为“伐木裕饷”),继续执行开山抚番政策,由地方巨商向政府官员捐输买官、提供民勇人丁,官员发动战争劫掠抢取土地,租给地方巨商招募民工脑丁入垦山林,所得再租税裕饷,如此循环,七年间持续发动一连串大嵙崁战役以帝国优势现代武力征伐今大溪、三峡、复兴、乌来等地的泰雅部落。
日治时延续清末开山抚番政策,随后更升级为理蕃政策,不承认族人领地权将山林强制没收为国有,樟脑业者垦民入侵部落领地开垦伐林不再付予当地住民赛夏、泰雅等部落租金补偿,不断暴力冲突终至引发南庄事件、大豹社事件等事件。至当地社群灭社后,引进工业化资本主义,大举经营台湾的樟脑产业全面收归国家垄断台湾北部、中部山林樟树之采伐,到了20世纪初日本成为全世界最大的樟脑生产国。
1920年代,化学合成制法逐渐流行,逐渐取代樟脑的地位,最终由于塑胶被发明、取代赛璐珞,樟脑产业就此没落。
樟脑的药理活性
1、樟脑在一种与香兰素无关的机制中激活并强烈脱敏瞬时受体电位香兰素亚型1通道
樟脑是一种自然产生的化合物,作为一种主要的有效成分的香油和搽剂提供局部止痛剂。尽管樟脑在医学上的使用历史悠久,但其作用的潜在分子机制尚不清楚。辣椒素和薄荷醇是另外两种广泛应用于类似目的的外用药物,已知它们通过作用于瞬时受体电位(TRP)通道超家族的两种成员:热敏TRP香草样亚型1 (TRPV1)和冷敏TRP通道M8来刺激和脱敏感觉神经。樟脑最近被证明可以激活TRPV1,在这里,我们发现樟脑也可以激活异型表达的TRPV1,这需要比辣椒素更高的浓度。通过模拟炎症条件的磷脂酶c偶联受体刺激增强了激活。在分离的大鼠DRG神经元中观察到类似樟脑激活的trpv1样电流,并在蛋白激酶C被佛波醇12-十四酸酯-13-乙酸酯(佛波酯,是蛋白激酶 C (PKC) 和 SphK 的激活剂)激活后增强。大鼠TRPV1的樟脑激活是由辣椒素不同的通道区域介导的,这表明樟脑激活存在竞争性抑制剂辣椒素和辣椒素不敏感点突变体。樟脑并没有激活辣椒素不敏感的鸡肉TRPV1。TRPV1脱敏被认为有助于辣椒素的镇痛作用。我们发现,虽然樟脑对TRPV1的激活作用较弱,但樟脑对TRPV1的脱敏作用比辣椒素更快、更彻底。相反,反复使用樟脑后TRPV3电流变得敏感,这与樟脑的镇痛作用不一致。我们还发现樟脑抑制了其他几个相关的TRP通道,包括锚蛋白-重复TRP 1 (TRPA1)。樟脑诱导TRPV1脱敏和TRPA1阻滞可能是樟脑镇痛作用的基础。[1]
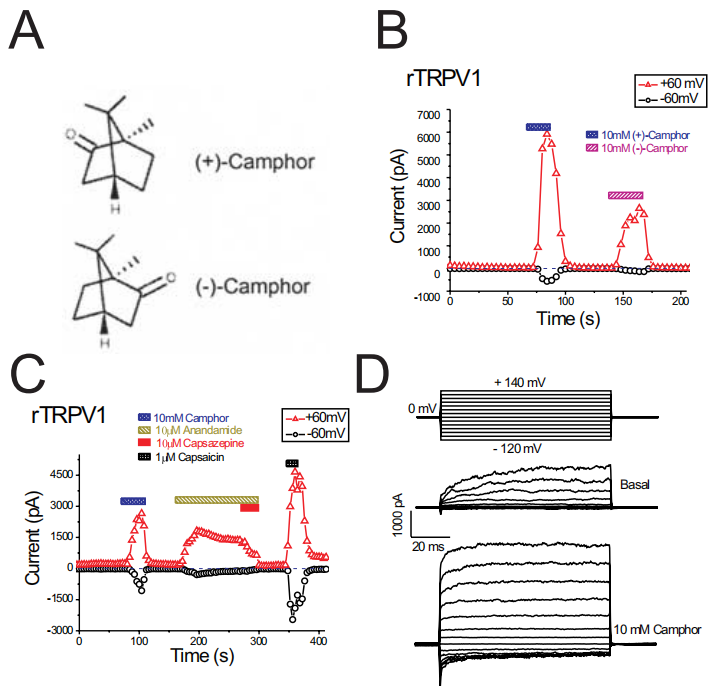
樟脑激活异型表达的大鼠TRPV1。A、樟脑(+)和(-)立体异构体的结构。B,两种樟脑立体异构体都激活了rTRPV1。(-)-樟脑与(+)-樟脑的作用较弱,可能是由于速发型过敏反应。每隔4秒施加400 ms从-100到+100 mV的电压斜坡诱发斜坡电流。每个符号表示+60mv(红色三角形)和-60mv(黑色圆圈)处的电流振幅。注意零电流水平(用蓝色虚线表示)。c, rTRPV1被樟脑,anandamide和辣椒素激活。辣椒素(10M)对anandamide诱导的电流有很强的抑制作用。D,樟脑对rtrpv1介导的电压步进电流的影响。[1]
2、樟脑白油通过细胞毒性T细胞依赖机制诱导肿瘤消退
樟树(Cinnamomum camphora)的生物活性衍生物已被证实具有化学预防作用,但这些天然产物的功效和作用机制尚未确定。我们测试了一种精油衍生物,樟脑白油(CWO),对角质细胞来源的皮肤癌小鼠模型的抗肿瘤活性。每日局部治疗CWO可诱导恶性前皮肤肿瘤显著消退,皮肤鳞状细胞癌减少两倍。我们下一步研究潜在的细胞和分子机制。在培养的角化细胞中,CWO刺激钙信号转导,导致钙调神经依赖激活T细胞核因子(NFAT)的激活。在体内,CWO诱导免疫相关基因的转录变化,导致细胞毒性T细胞依赖性肿瘤消退。最后,我们确定了CWO的化学成分,概括了外加剂的作用。总之,这些研究确定T细胞介导的肿瘤消退是植物来源的精油减少既定肿瘤负荷的机制。[2]
我们提出,CWO通过NFAT依赖信号和CD8+ T细胞依赖机制刺激皮肤肿瘤消退(下图)。与NFAT信号的参与相一致,我们的体外研究表明,CWO诱导了人角质形成细胞中的钙信号和钙/钙调神经磷酸酶依赖的NFAT易位。[2]
NFAT信号在角质形成细胞中的作用是多方面的和环境相关的。例如,Notch信号下游的NFAT激活已被证明可以诱导表皮角化细胞从增殖到分化的转换(Mammucari, Tommasi di Vignano, 2005, Santini, Talora, 2001)。在毛发周期中,NFAT信号通过抑制细胞周期调节因子CDK4促进膨大干细胞的静止(Horsley, Aliprantis, 2008, Mammucari, Tommasi di Vignano, 2005, Santini, Talora, 2001)。相比之下,表皮细胞中NFAT的过度激活促进角质形成细胞的过度增殖(Tripathi, Wang, 2014)。后一项报告与我们的发现一致,CWO促进正常人类角质形成细胞的增殖。[2]
如何增强角质细胞增殖与肿瘤消退相协调?一种可能是,CWO导致正常角质形成细胞增殖,并在代谢资源方面胜过癌症干细胞。另外,NFAT的激活可能会对正常干细胞和癌症干细胞产生不同的影响,促进前者的增殖,后者的沉默(Tripathi, Wang, 2014, Wu, Nguyen, 2010)。总的来说,这种增殖潜能的改变可以改变尺度,促进肿瘤消退。[2]
我们发现CWO在体内的抗肿瘤作用需要免疫细胞,这有利于另一种模型:CWO促进角质形成细胞NFAT易位,诱导细胞因子表达,改变肿瘤微环境,通过免疫细胞激活刺激肿瘤细胞清除。例如,最近的研究发现胸腺基质淋巴细胞生成素(TSLP)在角质形成细胞中释放NFAT激活下游(Wilson et al., 2013)。TSLP以促进过敏性炎症的作用而闻名(Ziegler, 2012),当从角质形成细胞中释放时,可以促进特应性进程,进而促进哮喘的发展(Zhang et al., 2009)。有趣的是,过敏性炎症可以降低某些癌症的风险,同时增加其他癌症的风险(Josephs等人,2013年)。一些有趣的研究表明,TSLP通过CD4+和CD8+ t细胞激活在刺激抗肿瘤免疫方面具有额外的作用(Demehri et al., 2016, Demehri et al., 2012, Di Piazza et al., 2012)。角质形成细胞释放的TSLP可直接刺激CD4+ TH激活和细胞毒性T细胞向肿瘤募集。有趣的是,我们发现CWO处理后的角质形成细胞中TSLP mRNA表达上调,提示这一信号通路可能有助于CWO介导的肿瘤消退。
除了对角质形成细胞的影响外,CWO还可以直接作用于T细胞,既可以通过皮肤中的居民群体作用,也可以通过全身作用(Medler & Coussens, 2014, Mueller等人,2014,Richmond & Harris, 2014)。NFAT亚型因其对T细胞的作用而被大量研究(Hogan, 2017)。在T细胞激活时,核NFAT蛋白与AP1转录因子结合,刺激与激活相关的基因表达。因此,CWO可以通过NFAT直接影响T细胞的活化动力学。未来研究的目标是确定CWO是否直接作用于角化细胞、免疫细胞或两者都能刺激抗肿瘤免疫。[2]
综上所述,本研究确定CWO是一种新型的NFAT信号和钙调磷酸酶介导的抗肿瘤免疫激活剂。接受钙调磷酸酶抑制剂长期治疗的器官移植受者SCC风险显著增加(Dotto, 2011, Goldstein, Fletcher, 2014, Horsley, Aliprantis, 2008, Keyes, Segal, 2013, Yamamoto & Kato, 1994),认为NFAT激活剂可能用于降低上皮肿瘤风险。由于这些研究调查了CWO和萜类化合物在诱导肿瘤后的疗效,因此需要进一步研究确定这些化合物是否也可以作为一种预防措施,减少癌前病变的发展。这增加了CWO可以作为一种有效的局部治疗,以防止角化细胞衍生性病变的进展的可能性。[2]
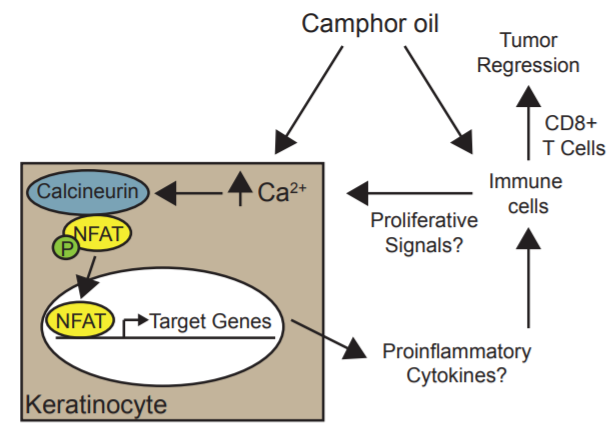
CWO的作用机制模型。CWO诱导钙/钙调素依赖性NFAT易位。NFAT诱导转录,进而改变肿瘤微环境,促进炎症和T细胞介导的肿瘤消退。[2]
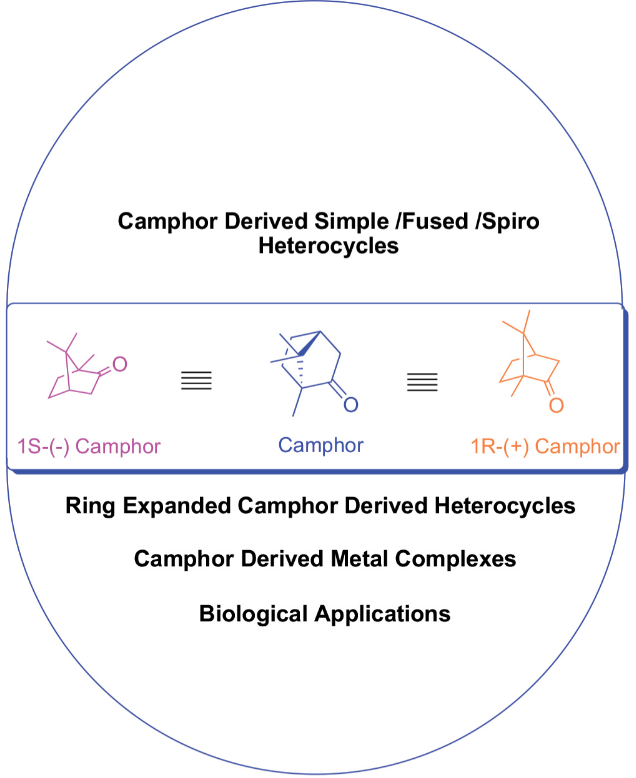
3、樟脑衍生物及其应用的研究进展
天然化合物是药物化学中合成丰富的生物活性物质的重要来源。樟脑以两种对映体形式存在,即R和S,或两者都存在,这是很容易得到的。樟脑是一种具有手性的小分子,它与某些活性位点结合,樟脑是广泛存在于植物中的一种重要的单萜类化合物,它是樟脑衍生物的原料,具有抗菌、抗病毒、抗氧化、抗氧化、止痛和抗癌等多种生物活性。许多这些简单的衍生物在商业上以樟脑磺酸或酮酸的形式存在,可以很容易地从樟脑中生产出来。该化合物主要用作天然产物对映体特异性合成的手性起始材料,因为其可用于直接或间接引入C-3、C-5、C-8、C-9和C-10碳原子的功能。本研究将从樟脑中提取的杂环化合物按不同的基团排列,包括樟脑简单杂环化合物、樟脑融合杂环化合物、螺环类樟脑衍生杂环化合物、环扩张型樟脑衍生杂环化合物和樟脑衍生金属配合物。本研究综述了樟脑及其衍生物的转化及其生物活性。
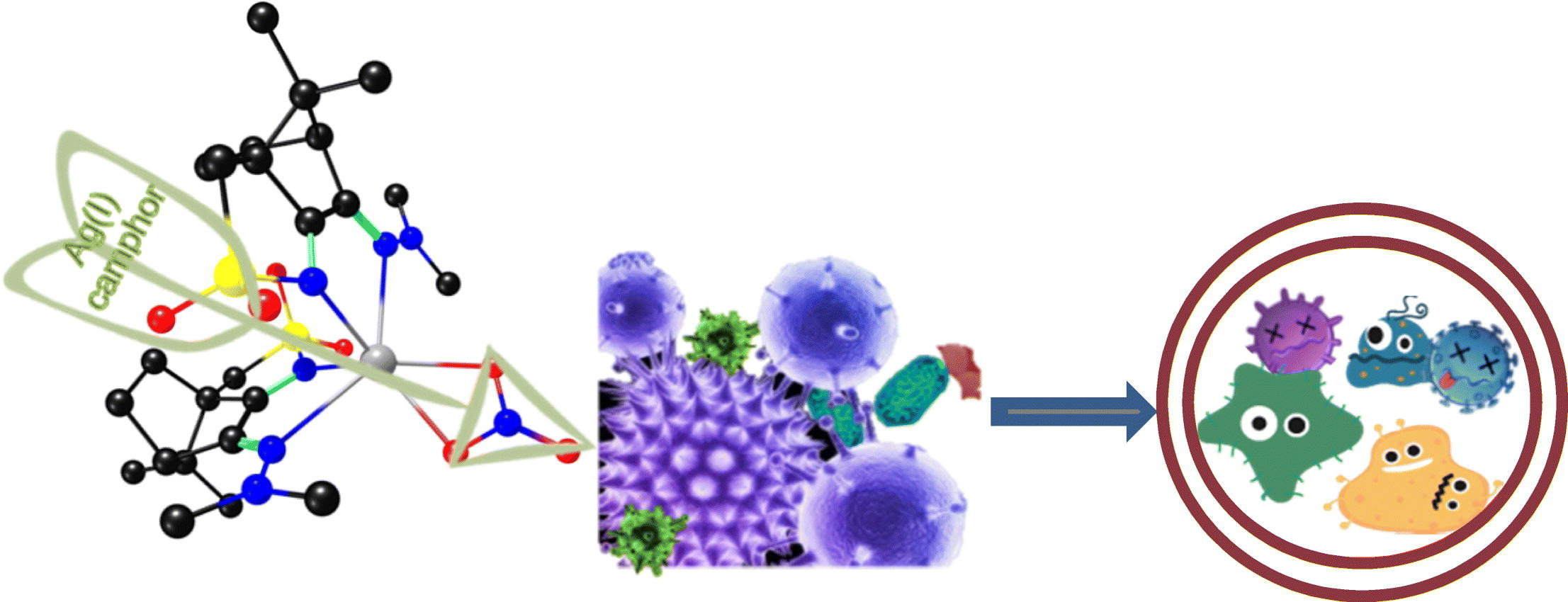
4、银(I)樟脑复合物:设计抗菌活性
与Ag(I)樟脑亚胺配合物[Ag(NO3)(OC10H14NY)2] (Y=NMe2(1))相对应的11个分子式[Ag(NO3)(L-Y)2]新配合物哦,(2);C6H5 (3);4-MeC6H4, (4);3, 5 - (CH3) 2 c6h3 (5);3-OHC6H4, (6);3-ClC6H4 (7);4-ClC6H4 (8);4-FC6H4 (9);合成了4-CF3C6H4(10)和樟脑磺酰亚胺配合物[Ag(NO3)(O2SNC10H14NY)2] (Y=NH2),并对其结构和抗菌活性进行了研究。选取其中5个配合物作为典型算例,用密度泛函理论计算优化了配合物的结构。结果表明,樟脑配体上的亚胺取代基(Y)驱动配合物的结构由扭曲的八面体向三角棱柱或线性离子转变,而磺酰亚胺环的作用对配合物的几何形状没有明显的影响。化合物的亲脂性和极性是关系到其生物活性的重要参数,同时也与樟脑配体的特性密切相关。用循环伏安法研究了配合物的氧化还原性质,结果表明,它们的还原电位基本上与它们的电子和空间性质无关。通过MIC值计算各配合物对革兰氏阳性菌(金黄色葡萄球菌Newman)和革兰氏阴性菌(大肠杆菌ATCC25922、铜绿假单胞菌477、伯克霍尔德菌IST408)的抑菌活性。结果表明,樟脑亚胺配体(1 ~ 10)配合物具有高脂亲和低偶极矩(3 ~ 5)的抗菌活性。建立氢键的能力是樟脑磺酰亚胺配合物11 (Y=NH2)抗菌活性的重要贡献。[4]
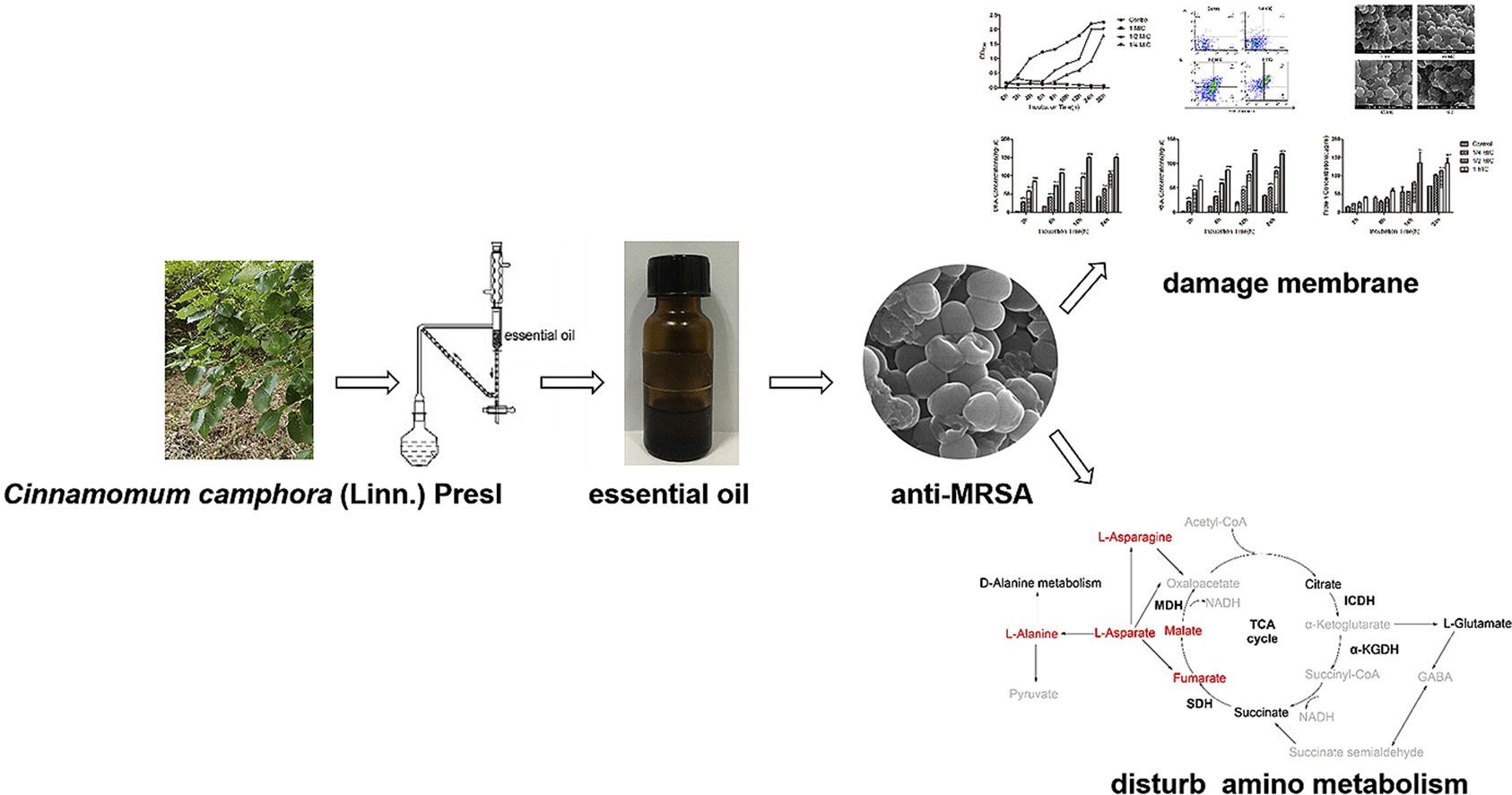
5、用代谢组学方法评价香樟叶挥发油的抑菌活性
香樟(Presl camphora)是最古老的传统中草药之一,具有抗菌、抗氧化、抗真菌、抗炎、杀虫、驱避等多种生物功能。客观的研究了香樟精油的抑菌活性及抑菌机理。采用水蒸气蒸馏法从香樟叶中分离得到精油,并采用气相色谱-质谱联用技术(GC-MS)对精油的化学成分进行分析。用微肉汤稀释法测定精油的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)。用比浊法测定生长曲线。流式细胞术检测细胞凋亡。用场发射扫描电镜和透射电镜观察细菌的形态变化。用NanoDrop和BCA蛋白检测试剂盒检测细胞膜的完整性。利用GC-MS代谢组学研究精油存在下耐甲氧西林金黄色葡萄球菌(MRSA)的代谢谱。采用商品化试剂盒检测异柠檬酸脱氢酶(ICDH)、α-酮戊二酸脱氢酶(α-KGDH)、琥珀酸脱氢酶(SDH)和苹果酸脱氢酶(MDH)活性。结果发现,香樟叶精油的主要成分为芳樟醇(26.6%)、桉叶醇(16.8%)、α-松油醇(8.7%)、异龙脑醇(8.1%)、β-水芹烯(5.1%)和樟脑(5.0%)。精油对金黄色葡萄球菌、粪肠球菌、枯草芽孢杆菌、鸡沙门氏菌和大肠杆菌均有较好的抑制活性。以MRSA为模型菌阐明精油的抗菌作用机理,其MIC值为0.8 mg/mL, MBC值为1.6 mg/mL。添加精油后,MRSA凋亡率呈浓度依赖性增加。精油破坏细胞形态。在代谢组学评价结果中,有74个代谢产物差异显著,其中29个代谢产物上调,45个代谢产物下调。七种途径被共享的差异代谢物丰富了。精油使ICDH活性提高47.35%,MDH、SDH和α-KGDH活性分别降低72.63%、31.52%和63.29%。樟树精油通过破坏细胞膜和干扰氨基代谢表现出抗耐甲氧西林金黄色葡萄球菌活性。
参考文献
[1] Xu, Haoxing & Blair, Nathaniel & Clapham, David. (2005). Camphor Activates and Strongly Desensitizes the Transient Receptor Potential Vanilloid Subtype 1 Channel in a Vanilloid-Independent Mechanism. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25. 8924-37. 10.1523/JNEUROSCI.2574-05.2005.
[2] Yalda Moayedi, Sophie A Greenberg, Blair A Jenkins, Kara L Marshall, Lina V Dimitrov, Aislyn M Nelson, David M Owens, Ellen A Lumpkin. Camphor white oil induces tumor regression through cytotoxic T cell-dependent mechanisms. bioRxiv 386789; doi: https://doi.org/10.1101/386789
Now published in Molecular Carcinogenesis doi: 10.1002/mc.22965
[3] Anjaneyulu Bendi, Sangeeta and Saini Naina , A Study on Camphor Derivatives and Its Applications: A Review, Current Organic Chemistry 2021; 25(12) . https://dx.doi.org/ 10.2174/ 13852 72825666210608115750
[4] M. Fernanda N.N. Carvalho, Silvestre Leite, Joana P. Costa, Adelino M. Galvão, Jorge H. Leitão,Ag(I) camphor complexes: antimicrobial activity by design,Journal of Inorganic Biochemistry,Volume 199,2019,110791,doi.:10.1016/j.jinorgbio.2019.110791.
[5] Yuquan Huang, Xinjun Xu, Wenjian Lan, Depo Yang, Metabolomics analysis to evaluate the antibacterial activity of the essential oil from the leaves of Cinnamomum camphora (Linn.) Presl, Journal of Ethnopharmacology,Volume 253,2020,112652,doi.10.1016/j.jep.2020.112652.